Cours de chimie Organique -
Représentation des molécules
Stéréodescripteurs
Règles séquentielles de R. S. Cahn, C. Ingold, V. Prelog
Définitions
La constitution d'une entité moléculaire précise la nature et les modes d'union des atomes formant cette entité, en incluant la multiplicité des liaisons sans tenir compte de leur disposition dans l'espace.
La configuration d'une entité moléculaire est la disposition spatiale des atomes ou des groupes d'atomes de cette entité. Ce terme est propre aux stéréo-isomères dont l'isomérie n'est pas due à des différences de conformations.
Les stéréo-isomères de configuration peuvent être classés en fonction de critère de symétrie. On distingue alors :
- les énantiomères ;
- les diastéréo-isomères.
Un atome ou un groupe d'atomes qui, dans une entité moléculaire, peut être considéré comme à l'origine d'une stéréo-isomérie est appelé groupe stéréogène. Deux exemples de groupes stéréogènes sont particulièrement importants :
- un atome asymétrique, centre chiral, avec les groupes qui lui sont liés ;
- un groupe d'atomes constitué d'une double liaison avec ses substituants qui peut donner naissance à une isomérie cis-trans.
Représentation en perspective & représentation de Cram
La représentation de Cram introduite par le chimiste américain D. J. Cram (UCLA) en 1953, utilise les conventions résumées ci-dessous pour le dessin des liaisons.
|
dans le plan
|
en avant du plan
|
en arrière du plan
|
stéréochimie non définie
|
|
trait simple
|
trait gras
|
trait pointillé.
|
trait ondulé
|
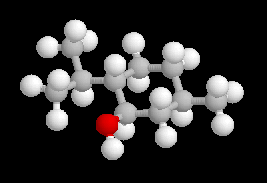 |
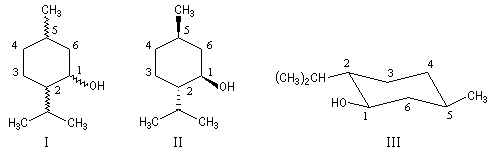
Le (-)-menthol ou menthol lévogyre, est le : (1R, 2S, 5R)-5-méthyl-2-isopropylcyclohexanol. Ce composé existe à l'état naturel dans l'essence de menthe. Le (-)-menthol est un composé important de l'industrie des arômes et des parfums. Sa synthèse industrielle à partir du myrcène peut être réalisée selon un procédé très élégant mis au point par la société Takasago dans lequel l'étape clé est une isomérisation énantiosélective mettant en jeu un catalyseur de Noyori. |
Donald J. Cram a été lauréat du prix Nobel de chimie en 1987 (conjointement avec J. M. Lehn et J. C. Pedersen) pour ses travaux concernant les complexes moléculaires de type "host-guest" tels que les éthers-couronnes et les cryptands [36].
Représentation de Haworth
Ce mode de représentation, introduit par le chimiste britannique Sir N. Haworth, est fréquemment utilisé dans la chimie des sucres et de leurs dérivés. Il est beaucoup plus commode que la représentation de Fischer dans le cas des structures cycliques. Les exemples ci-dessous, qui concernent les hémiacétals cycliques du glucose, montrent la filiation entre cette représentation et celle utilsant un cycle cyclohexanique en perspective qu'on utilise de plus en plus fréquemment à l'heure actuelle. On a représenté successivement :
- le a-glucopyranose (A) et (A') ;
- le b-glucopyranose (B) et (B').

La structure de l'ATP offre un exemple d'utilisation de ce mode de représentation. Le cycle central est celui d'un ribofurannose.
Projection de Newman
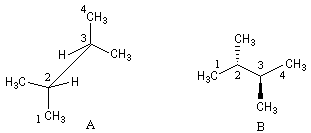
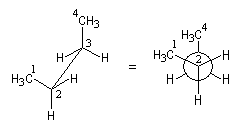
Cette technique de projection porte le nom du chimiste américain Melvin Spencer Newman (Ohio University) qui l'a introduite en 1952. La molécule est dessinée en projection selon une liaison C-C perpendiculaire au plan du papier [18].
L'exemple suivant est celui de la molécule de butane en projection selon C2-C3.
La molécule d'éthanal est représentée selon la même méthode.
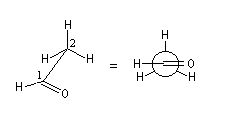
Projection de Fischer
Le chimiste allemand E. Fischer (prix Nobel 1902) à qui l'on doit notamment la détermination de la stéréochimie complète du glucose, ainsi que le modèle "clé-serrure" (en anglais : lock-key) est le créateur d'un mode de représentation très utilisé dans la chimie des sucres [32]. Les conventions sont les suivantes :
- la chaîne carbonée est dessinée verticalement ;
- l'atome de carbone qui porte le numéro le plus petit (porteur de la fonction aldéhyde dans le cas d'un sucre) est placé en haut ;
- les groupes sur l'horizontale pointent vers l'avant de la feuille de papier.
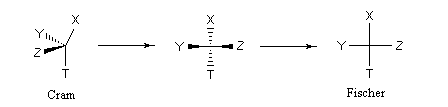
Définition
On appelle configuration absolue, la disposition spatiale des atomes ou des groupes d'atomes d'une entité moléculaire chirale ou d'un groupe chiral qui distingue cette entité ou ce groupe de son image dans un miroir. La configuration absolue est décrite par des stéréodescripteurs conventionnels.
Règles de R. S. Cahn, C. Ingold, V. Prelog
La nécessité de disposer d'une nomenclature systématique des énantiomères et des diastéréo-isomères, pose le problème de la recherche de descripteurs stéréochimiques. Les règles séquentielles proposées par R. S. Cahn, C. Ingold et V. Prelog établissent un ordre conventionnel des atomes ou des groupes d'atomes, dans le but de dénommer sans ambiguïté les configurations absolues ou relatives des stéréo-isomères [15] et [35].
C'est en 1966, lors de la conférence de Buerguenstock en Suisse, que Cahn, Ingold et Prelog s'engagèrent à utiliser les règles qui portent leurs noms dans tous les articles scientifiques traitant de stéréochimie [30].
- Règle 1 : un atome de numéro atomique plus élevé a la priorité sur un atome de numéro atomique plus faible.
Dans la molécule de bromochlorofluorométhane CHBrClF, les atomes
entourant le carbone central sont classés dans l'ordre suivant : Br >
Cl > F > H.
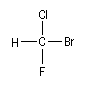
- Règle 2 : lorsque deux atomes, directement liés à
l'atome central (atomes dits de premier rang) ont même priorité, on
passe aux atomes qui leurs sont liés (atomes dits de second rang) et
ainsi de suite jusqu'à ce qu'on atteigne une différence.
Si l'on on veut comparer les priorités des atomes de carbone des groupes éthyle (I) et méthyle (II) :

Soit à comparer les atomes de carbone du groupe 2-méthylpropyle et du groupe butyle :

- Règle 3 : si le long d'une chaîne on atteint un endroit
ou il y a une bifurcation sans pouvoir conclure, on choisit un chemin
prioritaire correspondant à l'atome prioritaire des deux séries
identiques.
Si l'on veut comparer les atomes de carbone des groupes I et II :
au premier rang, on a deux séries (O, C, H) identiques et on ne peut conclure.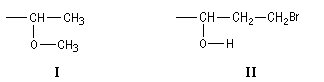
On compare alors les branches prioritaires correspondant à la bifurcation de l'atome d'oxygène. Le premier groupement est prioritaire sur le deuxième car l'atome de carbone l'emporte sur l'atome d'hydrogène.
- Règle 4 : les liaisons multiples sont ouvertes en
liaisons simples. On attache à chaque atome une réplique de l'atome qui
lui est lié jusqu'à saturer sa valence (les répliques sont notées entre [
]).
Exemples :
.
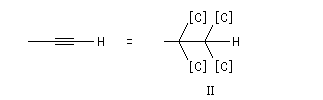
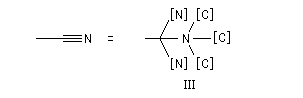
I > III > II - Règle 5 : quand deux atomes sont isotopes celui dont la masse est la plus élevée est prioritaire sur l'autre.
Un centre chiral est un atome maintenant un ensemble d'atomes ou de groupes d'atomes dans une disposition non superposable à son image dans un miroir. L'exemple le plus simple de centre chiral est l'atome de carbone lié à 4 groupes différents encore appelé depuis Van't Hoff, atome de carbone asymétrique. Le terme centre chiral s'applique aussi à des structures octaédriques ou ayant la forme d'une bipyramide trigonale qui ne sont pas forcément asymétriques.
Classons les groupes liés à un atome de carbone asymétrique par ordre de priorité en utilisant les règles séquentielles de Cahn, Ingold et Prelog et supposons qu'après classement on ait :
1 > 2 > 3 > 4
(le signe > signifie : est prioritaire devant).Un observateur dont l'œil est du côté de l'atome de carbone, regarde dans la direction de la liaison C-4 entre cet atome de carbone et le groupe classé dernier dans l'ordre des priorités. Deux situations peuvent alors se présenter :
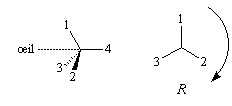 |
Les substituants défilent par priorité décroissante dans le sens des aiguilles d'une montre. La configuration absolue est R (rectus). |
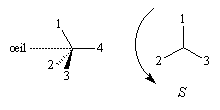 |
Les substituants défilent par priorité décroissante dans le sens inverse des aiguilles d'une montre. La configuration absolue est S (sinister). |
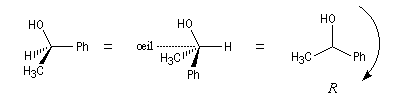
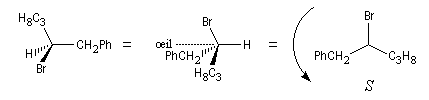
- molécule de (2R)-butan-2-ol
Le (2R)-butan-2-ol est représentée ci-contre.
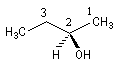 O(OH) > C3 > C1 > H
O(OH) > C3 > C1 > H - (2S)-1-phényl-2-aminopropane
Le (2S)-1-phényl-2-aminopropane (l'un des deux énantiomères de l'amphétamine) est un composé qui possède une action stimulante sur le système nerveux central.
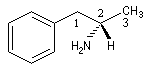 N(NH2) > C1 > C3 > H
N(NH2) > C1 > C3 > H - le (-) menthol est le (1R, 2S, 5R)-5-méthyl-2-isopropylcyclohexanol. Les configurations absolues des atomes asymétriques sont les suivantes :
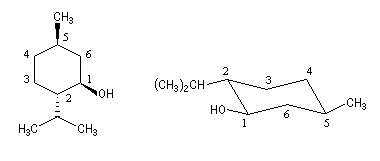 AtomeC1C2C5R : OH > C2 > C6 > HS : C1 > C(iPr) > C3 > HR : C6 > C4 > C(CH3) > H
AtomeC1C2C5R : OH > C2 > C6 > HS : C1 > C(iPr) > C3 > HR : C6 > C4 > C(CH3) > H
Le mot configuration désigne la disposition des atomes d'une entité moléculaire dans l'espace sans tenir compte des rotations autour des liaisons simples. La configuration absolue d’une structure dépend de sa configuration et des ordres de priorité des groupements selon les règles séquentielles de Cahn, Ingold et Prelog.
La réaction de substitution bimoléculaire suivante entre un ion alcynure et un dérivé halogéné, s'accompagne d'une inversion de configuration du centre chiral appelée inversion de Walden. En revanche la configuration absolue de la molécule n'est pas modifiée.
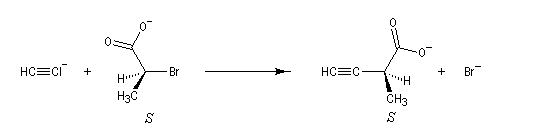
|
Composé
|
substrat
|
produit
|
|
Ordres de priorité
|
Br > C(CO2-) > C(CH3) > H
|
C(CO2-) > C(CCH) > C(CH3) > H
|
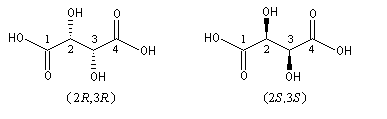
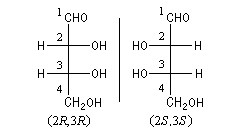
Lorsqu'une molécule possède plusieurs atomes de carbone asymétriques, on donne la configuration absolue de chacun d’eux. Les formules suivantes sont celles des acides tartriques ou (2R, 3R)-2,3-dihydroxybutane-1, 4-dioïque et (2S, 3S)-2,3-dihydroxybutane-1,4-dioïque énantiomères.
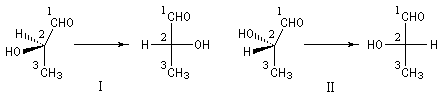
- si le substituant de plus petite priorité est situé sur la verticale, on regarde le sens dans lequel défilent les trois autres substituants par priorité décroissante. Si ce sens est celui des aiguilles d'une montre, la configuration absolue est R. Dans le cas inverse, elle est S (on peut se rappeler que lorsque le substituant de plus petite priorité est sur la verticale la configuration lue est la véritable configuration) ;
- si le substituant de plus petite priorité est situé sur l'horizontale, on effectue une permutation avec un substituant sur la verticale, on applique la règle précédente et on inverse la configuration absolue.
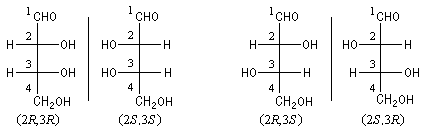
Il est représenté ci-dessous en utilisant successivement la représentation de Cram (I) et (II) et la projection de Fischer (III).
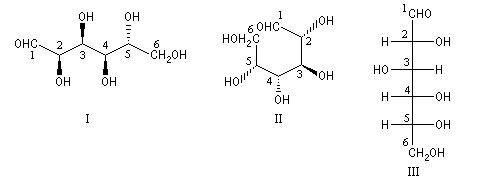
On pourra aussi examiner le cas des acides (2R)-2-hydroxypropanoïques et (2S)-2-hydroxypropanoïques (acides lactiques) ainsi que celui du menthol c'est à dire le (1R, 2S, 5R)-5-méthyl-2-isopropylcyclohexanol.
Pseudo-asymétrie
Il existe quatre stéréoisomères de la molécule de trihydroxy-2, 3, 4-pentanedioïque. Ces stéréoisomères peuvent être classés en un couple d'énantiomères et deux formes méso. Dans les stéréoisomères III et IV, l'atome C3 est substitué par deux atomes de constitution identique mais de configuration absolue différente. Il est dit pseudo-asymétrique. Sa configuration absolue est notée en minuscule.
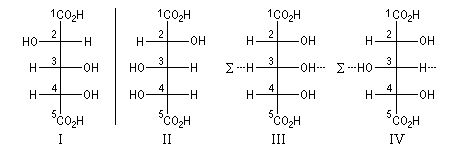
- un substituant de configuration absolue R est prioritaire sur un substituant de configuration absolue S ;
- les couples (R, R) et (S, S) sont prioritaires sur les couples (R, S) et (S, R) ;
- une double liaison de configuration Z est prioritaire sur une double liaison de configuration E.
|
Molécule
|
I
|
II
|
III
|
IV
|
|
Configuration absolue
|
(2S, 4S)
|
(2R, 4R)
|
(2R, 3r, 4S)
|
(2R, 3s, 4S)
|
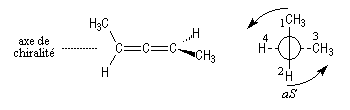
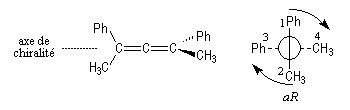
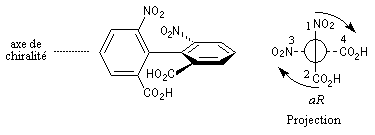
La molécule est observée selon l'axe de chiralité. On adopte les règles suivantes :
- les substituants en avant ont priorité sur ceux qui sont situés en arrière quelles que soient leurs natures respectives ;
- sur un même atome de carbone, les substituants sont classés selon les règles de priorité habituelles ;
- selon le sens de rotation dans lequel défilent les substituants on note aR ou aS.
Définitions
On appelle configuration relative la configuration de tout groupe stéréogène par rapport à tout autre groupe stéréogène contenu dans la même entité moléculaire.
À la différence de la configuration absolue elle est inchangée par réflexion.
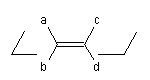
Configuration relative autour d'une double liaison
Les atomes de carbone et les atomes qui leurs sont liés, engagés dans une double liaison constituent des groupes stéréogènes. Considérons le plan passant par les atomes de carbone de la double liaison et perpendiculaire au plan passant par les groupes qui lui sont liés. Ces groupes sont situés au dessus et au dessous de ce plan.
- les groupes portés par des atomes de carbone différents situés du même côté du plan sont en relation cis ;
- les groupes portés par des atomes de carbone différents situés de part et d'autre de ce plan sont en relation trans.
|
Relation
|
cis
|
trans
|
|
Groupes
|
a et c ; b et d
|
b et c ; a et d
|
Stéréodescripteurs Z et E
Les groupes portés par chaque carbone sont classés par priorité décroissante en utilisant les règles séquentielles de Cahn, Ingold et Prelog. Supposons qu'on ait :
a > b et c > d
Deux situations se présentent selon que les groupes prioritaires
sont situés du même côté du plan passant par les atomes de carbone ou de
part et d'autre de ce plan :La première configuration est appelée Z (zusammen) la deuxième est appelée E (entgegen) ;
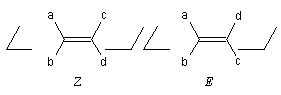

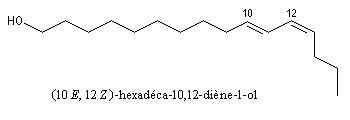
|
Le bombykol est une phéromone sexuelle du
Bombyx du mûrier. A. F. J. Butenandt et coll. (Allemagne) en ont obtenu
12 mg à partir d'un demi-million d'insectes. L'identification de ce
composé (1959) a demandé plus de 20 années de recherches. La
stéréochimie a été prouvée en comparant l'activité biologique des
différents isomères, obtenus par synthèse avec celle du bombykol
naturel. Il s'agit du (10E, 12Z)-Hexadécadiène-1-ol. Sa synthèse par H. J. Bestmann en 1977, illustre les possibilités synthétiques de la réaction de Wittig dans le contrôle de la stéréochimie. Une synthèse plus récente utilise le couplage de Suzuki comme étape clé. |
Configurations relatives de molécules possédant deux centres chiraux
Il s'agit de préciser la configuration relative d'un centre chiral par rapport à un autre centre chiral. Les stéréodescripteurs utilisés sont like et unlike, [16], [17].
|
Couples
|
(R, R) et (S, S)
|
(R, S) et (S, R)
|
|
Notation
|
R*R* ou like
|
R*S* ou unlike
|
|
Couples
|
 |
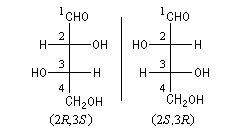 |
|
Notations
|
like
|
unlike
|
Lorsqu'une molécule possède deux atomes de carbone asymétriques, il existe au maximum 4 stéréoisomères qu'on peut grouper en deux couples d'énantiomères, sauf dans le cas où il existe un composé méso achiral.
On distingue ces couples par les notations érythro et thréo. Cet ancienne nomenclature trouve son origine dans l'étude des stéréoisomères du 2, 3, 4-trihydroxybutanal. Ces sucres peuvent être regroupés en deux couples d'énantiomères appelés respectivement érythrose et thréose.
On s'intéresse aux groupes portés par les atomes asymétriques C2 et C3. Les groupes sont classés selon les règles de priorité de Cahn, Ingold et Prelog. La molécule est observée en projection de Newman :
- les groupes défilent dans le même sens la configuration relative est érythro ;
- les groupes défilent dans des sens opposés la configuration relative est thréo.
|
Couples
|
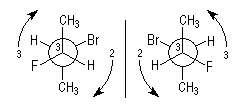 |
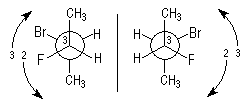 |
|
Notations
|
érythro
|
thréo
|
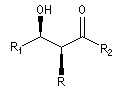
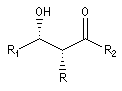
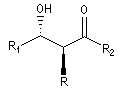
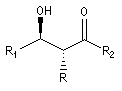
La chaîne carbonée principale dessinée en zig-zag est inscrite dans un plan. Les substituants sont en dessous ou au dessus de ce plan.
- dans le composé syn, les substituants -OH et -R sont situés du même côté du plan ;
- dans le composé anti, les substituants -OH et -R sont situés de part et d'autre du plan.
 |
 |
 |
 |
|
syn
|
syn
|
anti
|
anti
|
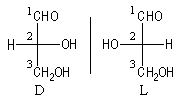
Nomenclature D, L de Fischer
Cas des sucres
La molécule est représentée en utilisant la projection de Fischer. On s'intéresse au groupe -OH situé sur le dernier atome asymétrique. Cet atome est donc différent selon le nombre d'atomes de la chaîne carbonée.
|
Projection du groupement -OH
|
à droite
|
à gauche
|
|
Série
|
D
|
L
|
. 
Pour les 2, 3, 4-trihydroxybutanals stéréoisomères (éryhtrose et thréose), il faut s'intéresser à la configuration du carbone 3. On a les résultats suivants :
|
Configuration absolue
|
(2R, 3R)
|
(2S, 3S)
|
(2R, 3S)
|
(2S, 3R)
|
|
Série
|
D
|
L
|
L
|
D
|
Origine de la nomenclature D, L
Deux composés énantiomères ont des pouvoirs rotatoires opposés. Faute de pouvoir déterminer la géométrie des deux glycéraldéhydes énantiomères, Fischer décida arbitrairement (il avait une chance sur de deux de trouver le bon résultat) que le composé dextrogyre était celui représenté à gauche sur le dessin précédent et il lui attribua la configuration D. Du même coup, l'énantiomère lévogyre devait être le composé L.
Quand en 1951 J. M. Bijvoet détermina expérimentalement, par une méthode spéciale de diffraction des rayons X, la structure d'un dérivé de l'acide (+)-tartrique, on pu connaître par corrélation de configuration celle du (+)-glycéraldéhyde. On constata que l'hypothèse qu'avait faite Fischer était la bonne.
Il n'existe cependant aucune relation générale entre la configuration D ou L d'une molécule et le signe (+) ou (-) du pouvoir rotatoire du composé. Certains composés appartenant à la série D sont lévogyres, d'autres de la série L sont dextrogyres (l'alanine naturelle par exemple).
On peut se rappeler qu'un composé de configuration D possède un groupe OH qui se projette à Droite en projection de Fischer.
Cas des aminoacides
La molécule est représentée en projection de Fischer. On s'intéresse au groupe amino porté par le premier atome de carbone asymétrique.
|
Projection du groupement -NH2
|
à droite
|
à gauche
|
|
Série
|
D
|
L
|
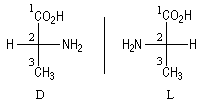
Prochiralité
Atomes prochiraux
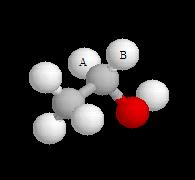
Commençons par étudier l'exemple de la molécule d'éthanol (1). Un observateur est capable de distinguer les atomes d'hydrogène HA et HB en repérant leur position par rapport aux autres atomes de la molécule c'est à dire en utilisant une référence interne. Cette observation peut être généralisée. Dans ce but, K. Mislow et M. Raban ont introduit un nouveau concept, celui de prochiralité (voir [19] et [35].)
Remplaçons chaque atome d'hydrogène successivement par un atome de deutérium. Nous obtenons respectivement les molécules (2) et (2') énantiomères. Nous dirons que les atomes HA et HB sont énantiotopiques.
Atomes d'hydrogène énantiotopiques de la molécule d'éthanol.
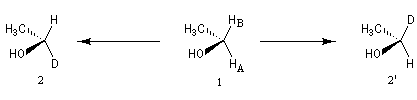 |
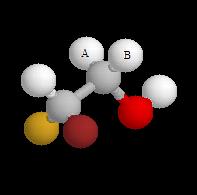
Atomes d'hydrogène diastéréotopiques de la molécule de bromofluoroéthanol.
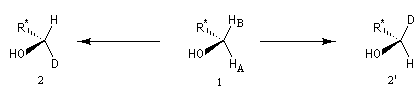 |
On peut classer les groupes prochiraux en utilisant des critères de symétrie. Deux groupes homotopiques ou équivalents sont échangeables par une opération de rotation Cn autour d'un axe. Ils sont stéréohétérotopiques dans le cas contraire.
|
Effet d'une rotation Cn
|
superposables
|
non superposables
|
|
Nature des groupements
|
homotopiques
|
stéréohétérotopiques
|
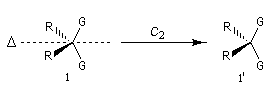
- un plan de symétrie ;
- un centre d’inversion ;
- un axe de rotation-réflexion.
|
Effet d'une symétrie Sn
|
superposables
|
non superposables
|
|
Nature des groupements
|
énantiotopiques
|
diastéréotopiques
|
- Groupes énantiotopiques
Deux groupes énantiotopiques appartiennent à des environnements énantiomères. Autrement dit, ils sont identiques du point de vue de la constitution et situés dans des régions symétriques d’une entité moléculaire, apparentées l’une à l’autre par des éléments de symétrie qui peuvent être un plan de symétrie, un centre d’inversion ou un axe inverse de symétrie. Ils possèdent des déplacements chimiques égaux en spectroscopie de RMN (ils sont isochrones). Cependant un réactif chiral peut les distinguer et ils peuvent être distingués en RMN en présence d'un solvant chiral.
Exemple : la molécule suivante possède un plan de symétrie. Les groupes G sont échangeables par une opération de symétrie S1.
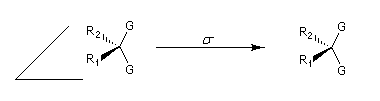
- Groupes diastéréotopiques
Des groupes diastéréotopiques sont identiques du point de vue de la constitution et situés dans des environnements diastéréo-isomères. Un réactif achiral peut les distinguer et leurs déplacements chimiques sont différents en RMN.
Exemple : un cas fréquent en pratique est celui dans lequel un groupe chiral interdit l'échange par symétrie des groupes G du fait de la présence d'un groupe chiral R1.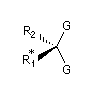
Rendons arbitrairement prioritaire l'un des groupes par rapport à l'autre et classons les groupes en utilisant les règles de Cahn, Ingold et Prelog. S'il s'agit de deux atomes d'hydrogène on peut remplacer l'un d'eux par un atome de deutérium (méthode de Hirschmann.) Deux cas peuvent alors se présenter :
- on obtient un groupe de configuration absolue R, le groupe est pro-R ;
- on obtient un groupe de configuration absolue S, le groupe est pro-S.
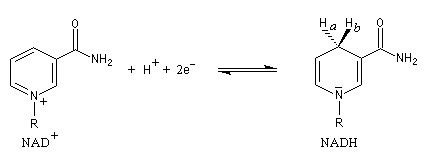
|
Atome
|
Ha
|
Hb
|
|
Stéréodescripteur
|
pro-S
|
pro-R
|
Le concept de prochiralité peut être étendu aux atomes trigonaux dont l'environnement est localement plan. On peut alors distinguer deux faces.
Raisonnons sur l'exemple du groupe carbonyle du benzaldéhyde. L'addition de l'ion cyanure (groupe achiral) sur cette molécule, suivie d'une acidification, peut s'effectuer avec une égale probabilité sur l'une ou l'autre des deux faces du groupe carbonyle. Cela conduit aux hydroxynitriles I et II énantiomères. On dit que les faces du groupe carbonyle sont énantiotopiques.
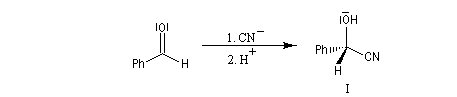
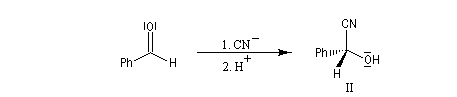
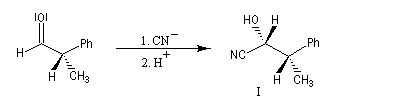
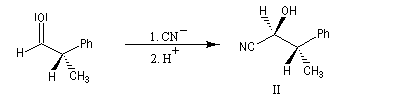
Faces prochirales et symétrie
Considérons à présent un atome de carbone impliqué dans une double liaison. Les liaisons qu'il développe appartiennent à un même plan. Ce dernier partage l'espace en deux parties. On distingue trois cas :
- Faces homotopiques
Une opération de symétrie C2 permet de passer de l'une à l'autre. Un observateur ne peut pas les distinguer. Elles sont parfaitement équivalentes.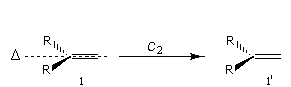
- Faces énantiotopiques
Elles se transforment dans une opération de symétrie plane. Un réactif achiral ne peut pas les distinguer. En revanche, un réactif chiral ou un observateur peuvent le faire.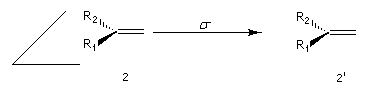
- Faces diastéréotopiques
Aucune opération de symétrie ne permet de passer de l'une à l'autre. Dans l'exemple ci-dessous un seul des groupes est chiral. Un réactif achiral peut les distinguer.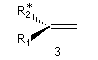
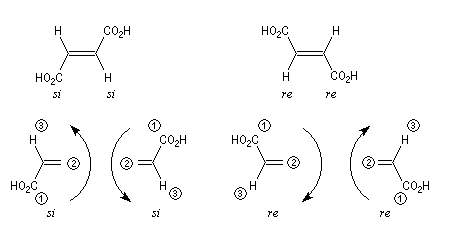
Une nomenclature des faces prochirales a été proposée K. R. Hanson [20] ; [35] et [37]. Elle est basée sur une généralisation des conventions de Cahn Ingold et Prelog. Les groupes sont classés dans l'ordre des priorités décroissantes :
1 > 2 > 3
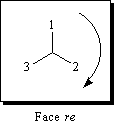 |
Pour un observateur situé devant la face étudiée, les substituants défilent par priorité décroissante dans le sens des aiguilles d'une montre. La face est re (rectus). |
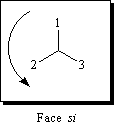 |
Pour un observateur situé devant la face étudiée, les substituants défilent par priorité décroissante dans le sens inverse des aiguilles d'une montre. La face est si (sinister). |
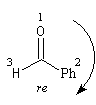 |
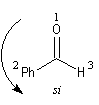 |
 |
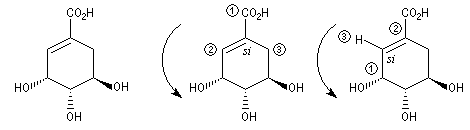
L'acide (-)-shikimique ou acide (3R,4S,5R)-3,4,5-trihydroxycyclohex-1-ène-1-carboxylique) est extrait de la badiane de chine ou anis étoilé. Il peut aussi naturellement être obtenu de façon synthétique [39]. Ce composé d'origine naturelle sert de point de départ à l'hémisynthèse stéréosélective du Tamiflu, un antiviral [40]. |
Ouvrages théoriques
[1] J. March - Advanced organic chemistry, Wiley Interscience.
[2] F. A. Carey, R.J. Sundberg - Advanced organic chemistry, 3d edition (Plenum Press, 1990).
[3] André Collet, Jeanne Crassous, Jean-Pierre Dutasta, Laure Guy. Molécules chirales : stéréochimie et propriétés. EDP Sciences, CNRS Editions.
[4] Enantiomers, racemates, and resolutions, Jean Jacques, André Collet, Samuel H Wilen 1981.
[5] H. Kagan - La stéréochimie organique (PUF, 1975).
[6] E. L. Eliel, S. H. Wilen, Stéréochimie des composés organiques (Tec et Doc).
[7] J. L Pierre - Principes de stéréochimie organique statique (A. Colin, 1971).
[8] A. Kirmann, J. Cantacuzène, P. Duhamel - Chimie organique T 1 (A. Colin, 1971).
[9] K. Mislow - Introduction to stereochemistry (W. A Benjamin, New York, 1966).
[10] J. Jacques - La molécule et son double (Hachette, 1992).
Articles
[15] R. S. Cahn, C. K. Ingold and V. Prelog, Angew. Chem. 78, 413-447 (1966), Angew. Chem. Internat. Ed. Eng. 5, 385-415, 511 (1966) ; et V. Prelog and G. Helmchen, Angew. Chem. 94, 614-631 (1982), Angew. Chem. Internat. Ed. Eng. 21, 567-583 (1982).
[16] V. Prelog and G. Helmchen, Angew. Chem. 94, 614-631 (1982), Angew. Chem. Internat. Ed. Eng. 21, 567-583 (1982).
[17] V. Prelog, D. Seebach, L'actualité chimique, juin-juillet (1983).
[18] Newman, M. S. A notation for the study of certain stereochemical problems. J. Chem. Educ. 1955, 32, 344-347.
[19] K. Mislow, M. Raban, "Stereoisomeric Relationships of Groups in Molecules", Top. Stereochem. 1967, 1, 1.
[20] Kenneth R. Hanson, Applications of the Sequence Rule. I. Naming the Paired Ligands g,g at a Tetrahedral Atom Xggij. II. Naming the Two Faces of a Trigonal Atom Yghi, J. Am. Chem. Soc., 1966, 88 (12), pp 2731–2742.
[21] V. Pellegrin - Les représentations graphiques bidimensionnelles des molécules en chimie organique (Bulletin de l'Union des Physiciens, février 1999).
Liens
[30] Systematic Stereochemical Nomenclature & Vladimir Prelog
[31] Glossary of terms used in physical organic chemistry IUPAC recommendations 1994.
[32] E. Fischer, The Nobel Prize in Chemistry 1901
[33] Sir N. Haworth, The Nobel Prize in Chemistry 1937
[34] A. Butenandt, The Nobel Prize in Chemistry 1939
[34] Chemtube 3D (University of Liverpool)
[35] Stereochemistry Articles Une sélection d'articles de référence en stéréochimie (Jay Siegel Research Group.)
[36] Nobel prize in chemistry 1987
[37] Prochirality Ernest L. Eliel, Department of Chemistry, University of North Carolina, Chapel Hill, NC 27514, USA.
[38] On the Classification of Pairwaise relations between isomeric structures Kurt Mislow, Dept of Chemistry, Princeton, University.
[39] Chemical Synthesis of Shikimic Acid and its Analogues by Shende Jiang and Gurdial Singh
[40] Chemical Synthesis of Tamiflu by Emily Campbell

Aucun commentaire:
Enregistrer un commentaire