Cours de chimie Organique -
Eléments de stéréochimie dynamique
Définitions
La stéréochimie dynamique s'intéresse aux relations entre le déroulement des réactions chimiques et la stéréochimie des composés impliqués dans ces réactions. L'analyse conformationnelle fait partie intégrante de la stéréochimie dynamique.
Conformations
Série acyclique
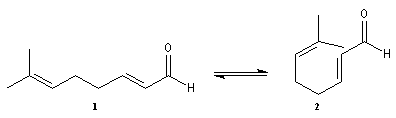
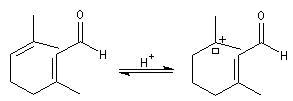
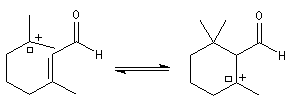
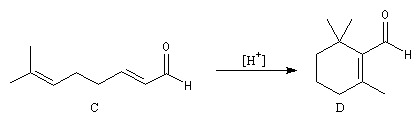
Le citral et le b-cyclocitral sont des isomères de fonction. L'isomérisation du citral C en b-cyclocitral D est catalysée par les ions H+.
Cet exemple illustre l'importance qu'il y a dans certains cas à prendre en considération certaines conformations particulières d'une molécule.
Dans l'étape de cyclisation, la molécule doit adopter une conformation permettant le rapprochement à une distance convenable des extrémités de la molécule.
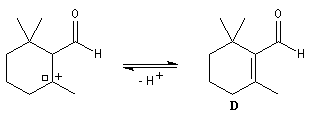
Les effets conformationnels en série cyclohexanique peuvent être étudiés en utilisant des cycles substitués par un groupement volumineux comme le groupe tertiobutyle. Les dérivés substitués de la (trans)-décaline ont été aussi utilisés.
Les résultats ci-dessous concernent les vitesses relatives d'acétylation par l'anhydride acétique des diastéréoisomères cis et trans des tertiobutylcyclohexanols selon E. L. Eliel [1].
|
Composé
|
R2 (cis)
|
R1 (trans)
|
|
Vitesse relative d'acétylation
|
1
|
3,7
|
- l'étape cinétiquement déterminante est l'attaque nucléophile du groupe hydroxyle de l'alcool sur le carbonyle de l'anhydride qui conduit à un intermédiaire tétraédrique ;
- la fragmentation de l'intermédiaire tétraédrique intervient dans une seconde étape plus rapide.
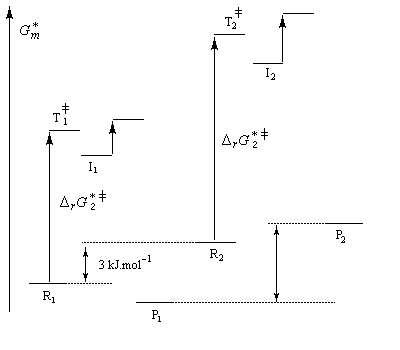
|
Intermédiaire
|
I2
|
I1
|
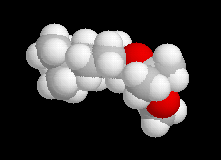
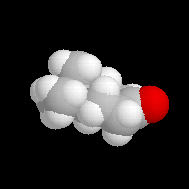
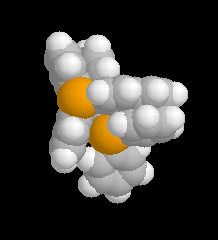
| Les schémas ci-contre représentent les intermédiaires I1 et I2 à l'aide des rayons de Van der Waals des atomes (représentation spacefill). On met ainsi en évidence les interactions 1, 3-diaxiales dans I2 qui n'apparaissent pas dans I1. |
|
Intermédiaire
|
I2
|
I1
|
|
Structure
|
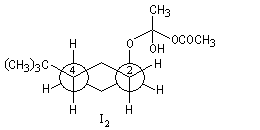 |
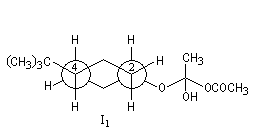 |
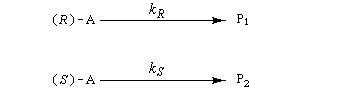
On s'intéresse au cas où des réactifs notés R1 et R2 en équilibre rapide, sont l'objet de réactions compétitives. R1 conduit au produit P1 tandis que R2 conduit à P2.
Cette situation se rencontre notamment lorsque deux conformères réagissent avec des vitesses différentes. La plupart du temps, en effet, le passage d'une conformation à l'autre ne nécessite qu'une faible réorganisation de la structure. L'enthalpie libre d'activation correspondante est donc petite en comparaison de celles qui sont mises en jeu dans les réactions des conformères vis à vis du réactif.
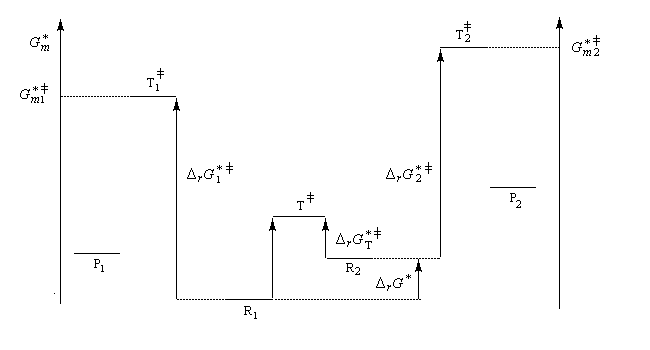
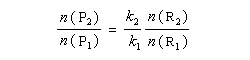
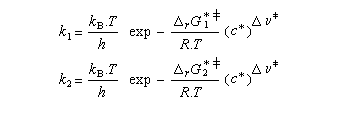
Comme exemple d'application du principe de Curtin-Hammett, considérons la réaction de Diels-Alder entre un diénophile comme le dicyano-1,2-éthène et le buta-1,3-diène.
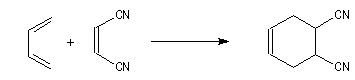
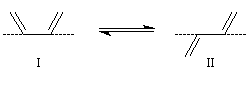
Le principe de Curtin-Hammett trouve aussi une illustration dans le dédoublement cinétique dynamique.
Les types d'inversion stéréochimiques
Racémisation
Il s'agit de la transformation qui accompagne le passage d'un composé énantiopur au mélange racémique des deux énantiomères. Elle s'accompagne d'une diminution du pouvoir rotatoire de la solution, de la valeur caractéristique du composé pur jusqu'à zéro.
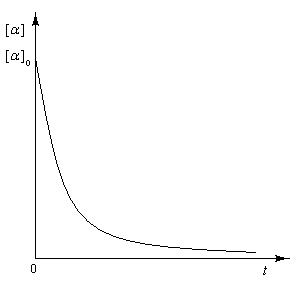
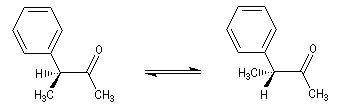
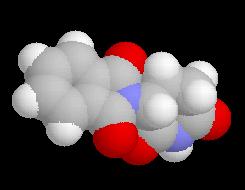 |
La molécule ci-dessous représente l'énantiomère (-) de la thalidomide. Le centre chiral possède une configuration absolue S. La molécule a une action sédative non toxique. Cependant ce centre chiral n'est pas stable et in vivo, on observe une racémisation qui conduit à l'énantiomère R tératogène.
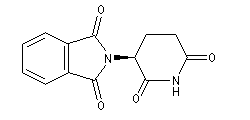 |
Il s'agit de la transformation qui accompagne la mise en équilibre de deux épimères. C'est donc une interconversion entre des diastéréo-isomères particuliers. Puisque les diastéréo-isomères sont chiraux ou non, cette transformation peut ou non s'accompagner d'une modification du pouvoir rotatoire de la solution.
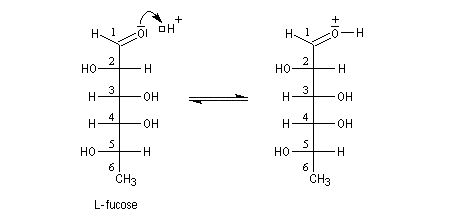
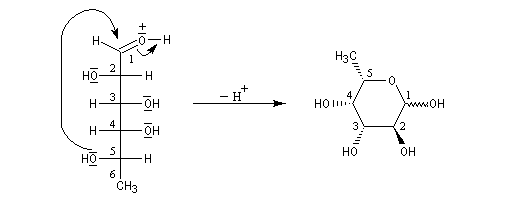
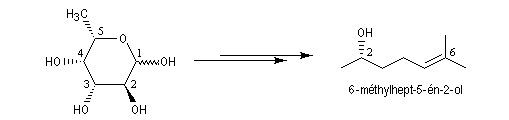
Un exemple est fournit par l'épimérisation en C2 des aldohexoses qui met en jeu la tautomérie céto-énolique.
On rencontre aussi ce type de transformation dans l'hémiacétalisation des sucres. On préfère parler dans ce cas d'anomérisation pour distinguer cette épimérisation particulière dans laquelle la transformation affecte l'atome de carbone de la fonction hémiacétal. Dans ce cas, les molécules sont chirales, et le pouvoir rotatoire passe de la valeur caractéristique des épimères purs (A) ou (B) à celle du mélange en équilibre des deux épimères. L'exemple suivant concerne les hémiacétals cycliques du glucose. Le a-D-glucopyranose et le b-D-glucopyranose.
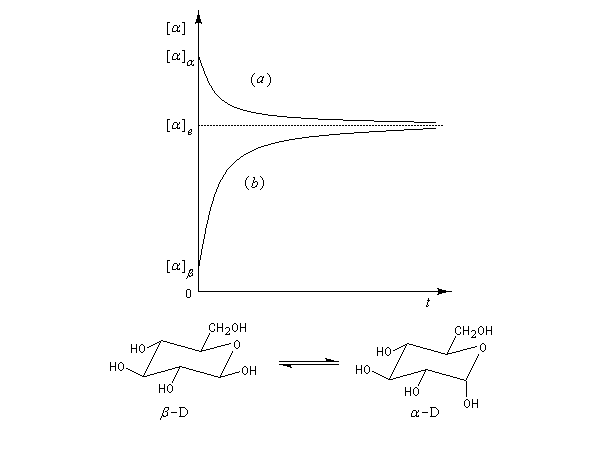
|
Composé
|
a-D-glucopyranose
|
b-D-glucopyranose
|
Mélange à l'équilibre
|
|
[a] (°.g-1.cm3.dm-1)
|
112
|
19
|
52,2
|
Le dédoublement cinétique est basé sur le fait que les constituants d'un mélange racémique réagissent avec des vitesses différentes avec un réactif chiral ou au cours d'une réaction énantiosélective catalysée par un catalyseur chiral. Il s'agit donc d'une réaction sous contrôle cinétique. La différence de vitesse des deux réactions provient du fait que les états de transition formés entre le substrat et le catalyseur sont diastéréo-isomères. Le profil énergétique de telles réactions énantiosélectives est étudié dans un paragraphe particulier.
Si C0 désigne la concentration totale en A racémique, CR et CS, les concentrations en énantiomères (R)-A et (S)-A respectivement. Le taux de conversion t est défini par la relation :
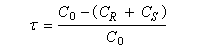
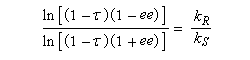
- le taux de conversion est élevé ;
- le facteur de stéréosélectivité est plus grand.
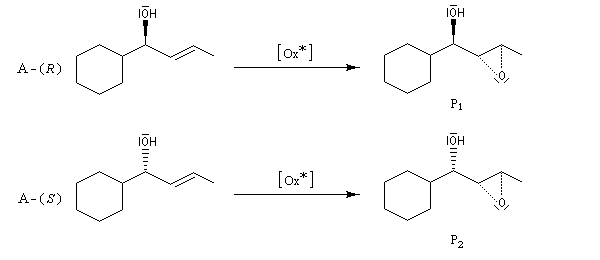
L'époxydation de Sharpless des alcools allyliques a été utilisée dans ce but. La réaction conduisant à P1 est beaucoup plus rapide que celle conduisant à P2 (kR/kS = 140)
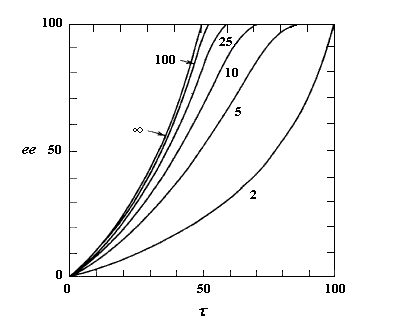
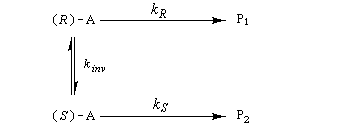
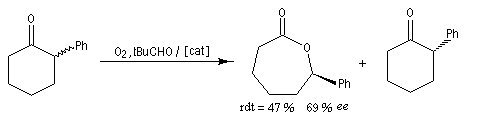
Considérons comme précédemment deux énantiomères (R)-A et (S)-A impliqués dans une réaction énantiosélective vis à vis d'un réactif R ou d'un catalyseur chiraux avec des constantes de vitesse différentes kR et kS. Cette fois, les deux énantiomères sont impliqués dans un équilibre de racémisation. Si cet équilibre est suffisamment rapide par rapport à la réaction énantiosélective, le principe de Curtin-Hammett montre qu'on va obtenir majoritairement un seul des deux énantiomères. La séparation peut conduire théoriquement à un rendement de 100 %. C'est le principe de la méthode de dédoublement cinétique dynamique (en anglais : dynamic kinetic resolution DKR).
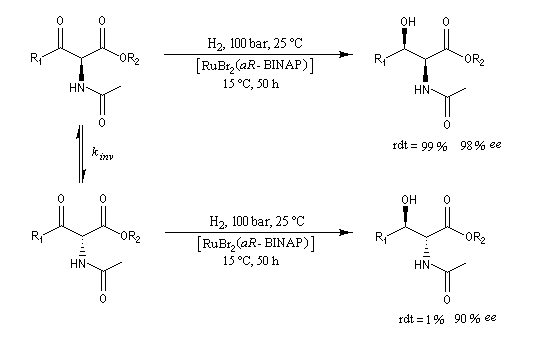
L'hydrogénation énantiosélective des b-céto-esters a été étudié par Noyori [10].
Sélectivité, stéréospécificité
Réactions stéréosélectives
Considérons une réaction au cours de laquelle un substrat A conduit à plusieurs produits stéréoisomères : A1, A2, ... , An. Cette réaction est qualifiée de stéréosélective si elle conduit de façon préférentielle, voire exclusive, à l'un d'entre-eux :
- une réaction diastéréosélective est une réaction au cours de laquelle un ou plusieurs éléments stéréogènes nouveaux sont introduits dans une molécule de manière telle que des diastéréo-isomères sont produits en quantités inégales ;
- une réaction énantiosélective est une réaction au cours de laquelle sont obtenus, à partir d’un précurseur achiral, deux énantiomères d’un produit chiral en quantités inégales.
- composés énantiopurs 51 % ;
- composés achiraux 32 % ;
- mélanges racémiques 17 %.
Considérons une réaction de grande stéréosélectivité permettant la transformation d'un substrat A en un produit A1. La réaction est dite stéréospécifique si un stéréoisomère B de A donne, dans les mêmes conditions, un produit B1, stéréoisomère de A1. Autrement dit, dans une réaction stéréospécifique, la stéréochimie des produits est déterminée par celle du substrat.

- Une réaction diastéréospécifique fournit des produits diastéréo-isomères lorsqu'elle est réalisée à partir de deux substrats qui ne diffèrent que par leur configuration relative.
Exemple : l'hydrogénation catalytique sur Ni de Raney du (Z)-3,4-diméthylhex-3-ène de configuration Z fournit le (3R, 4S)-diméthylhexane (1') (composé unlike) à l'exclusion du couple d'énantiomères
(3R, 4R)-diméthylhexane et (3S, 4S)-diméthylhexane tous deux diastéréo-isomères du précédent.
Dans les mêmes conditions, l'hydrogénation du (E)-3,4-diméthylhex-3-ène de configuration E fournit les énantiomères (3R, 4R)-diméthylhexane et (3S, 4S)-diméthylhexane 2' et 2'' (couple like) à l'exclusion du (3R, 4S)-diméthylhexane.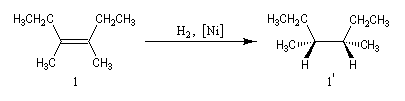 Un autre exemple de réaction diastéréospécifique est fourni par l'élimination bimoléculaire E 2 sur les dérivés halogénés.
Un autre exemple de réaction diastéréospécifique est fourni par l'élimination bimoléculaire E 2 sur les dérivés halogénés.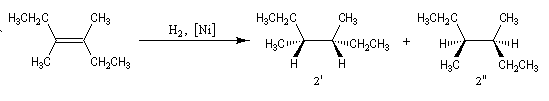
- Une réaction énantiospécifique fournit des produits énantiomères à partir de deux substrats qui ne diffèrent que par leur configuration absolue.
Exemple : lorsqu'on effectue la réaction entre le (1S)-1-bromo-1-deutéroéthane de configuration absolue S (1) et NaI dans l'acétone, on obtient
le (1R)-1-iodo-1-deutéroéthane (1') à l'exclusion de son énantiomère le (1S)-1-iodo-1-deutéroéthane.
Dans les mêmes conditions, le (1R)-1-bromo-1-deutérobutane (2) fournit le (1S)-1-iodo-1-deutéroéthane (2').
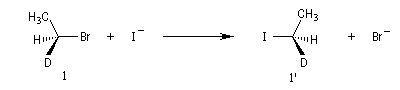 L'inversion de configuration du centre chiral porte le nom d'inversion de Walden.
L'inversion de configuration du centre chiral porte le nom d'inversion de Walden.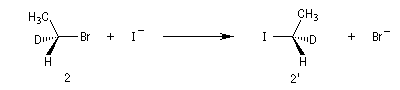
Remarque 2 : la stéréospécificité peut être totale ou partielle. Dans ce cas, il y a formation préférentielle de stéréoisomères.
Remarque 3 : une réaction stéréospécifique est toujours stéréosélective mais l'inverse n'est pas vrai. L'hydrogénation d'un alcyne catalysée par le palladium de Lindlar est une réaction fortement diastéréosélective de stéréochimie syn.
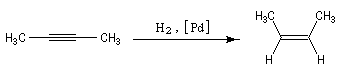
Rapport diastéréoisomérique, excès diastéréoisomérique
Considérons un mélange de diastéréo-isomères A1 et A2 de concentrations respectives C1 et C2. On adopte les définitions suivantes :
- le rapport diastéréo-isomérique (en anglais : diastereoisomeric ratio) la quantité (C2 < C1) :
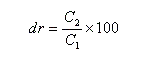
- l'excès diastéréo-isomérique (en anglais : diastereoisomeric excess) est défini par :
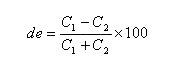
Considérons une solution constituée d'un mélange d'énantiomères A1 et A2. Faisons l'hypothèse que l'un des énantiomères, par exemple A1 est prépondérant. Désignons respectivement par C1 et C2 les concentrations des énantiomères A1 et A2. On appelle rapport énantiomérique (en anglais : enantiomeric ratio), la quantité (C2 < C1) :
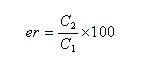
- pour un énantiomère A1 pur : er = 0 ;
- pour un mélange racémique : er = 1.
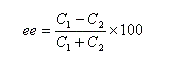
- si l'énantiomère A1 est pur : ee = 100 ;
- si le mélange est un mélange racémique de A1 et de A2 : ee = 0.
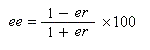
L'une méthodes les plus simples qui sont utilisées pour mesurer les excès énantiomériques est la polarimétrie. Dans le paragraphe consacré aux méthodes chiroptiques, on a introduit la notion de pureté pureté optique po grandeur adaptée à la mesure du pouvoir rotatoire. Lorsque la loi d'additivité est applicable (ce qui suppose l'absence de phénomènes non linéaires tels que l'effet Horeau) l'excès énantiomérique (ee) est égal à la pureté pureté optique. Une autre technique largement employée est l'utilisation d'agents chiraux de dérivatisation. L'idée est de substituer à la mesure de l'excès énantiomérique celle d'un excès diastéréoisomérique. Le principe est schématisé sur le dessin ci-dessous :
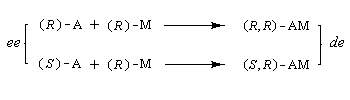
Dans l'exemple ci-dessous, c'est le chlorure d'acyle, du MTPA qui est utilisé car il est plus réactif que le MTPA lui même.
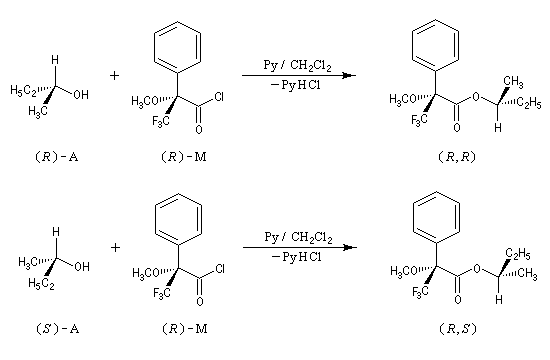
- la transformation est totale ;
- on n'observe pas de dédoublement cinétique qui provoquerait une modification de la composition du mélange.
Synthèse asymétrique, induction asymétrique
La synthèse stéréosélective d'un composé chiral à partir d'un précurseur achiral sans recours à des dédoublements de produits ou d'intermédiaires racémiques est appelée traditionnellement synthèse asymétrique. Il existe un désaccord sur l'extension de cette définition à des substances dont les molécules comportent déjà un ou plusieurs éléments chiraux, et dans lesquelles la synthèse introduit un nouvel élément chiral. C'est la raison pour laquelle il est préférable de remplacer ce terme traditionnel par synthèse stéréosélective et plus précisément par synthèse énantiosélective ou synthèse diastéréosélective selon le cas.
Le terme d'induction asymétrique se réfère à la formation prédominante de l’un des énantiomères ou diastéréo-isomères possibles au cours d’une réaction sous l’influence d’un facteur chiral.
On distingue, par ordre chronologique, plusieurs générations de méthodes mises au point et employées dans la synthèse de composés chiraux :
- utilisation d'un substrat de départ appartenant au fond chiral (en anglais : chiral pool). Il s'agit donc ici plutôt d'hémisynthèse ;
- un auxilliaire chiral est lié temporairement au substrat de façon covalente puis détaché de celui-ci en fin de réaction ;
- le substrat chiral réagit avec un réactif chiral ;
- le substrat prochiral réagit avec un réactif achiral en présence d'un catalyseur chiral.
On appelle fonds chiral (en anglais : chiral pool) l'ensemble des molécules chirales d'origine naturelle.
- aminoacides ;
- aminoalcools ;
- hydroxyacides ;
- terpènes ;
- sucres ;
- les alcaloïdes sont des composés azotés hétéroycliques basiques.
Il faut distinguer le cas d'une synthèse diastéréosélective de celui d'une synthèse énantiosélective.
- Dans une synthèse diastéréosélective, les produits n'ont pas
la même enthalpie libre de référence. On distingue deux cas selon que
le produit cinétique (le plus vite formé) est, ou non, différent du produit thermodynamique (le plus stable). Cela est illustré ci-dessous sur l'exemple de la préparation
de deux couples de molécules P1 et P2 possédant deux centres chiraux à partir d'un même substrat A. ;
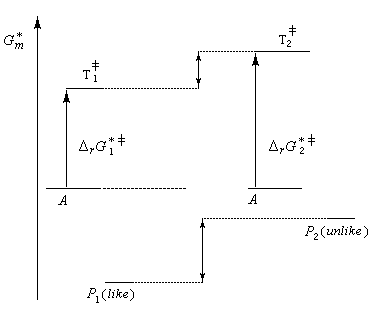
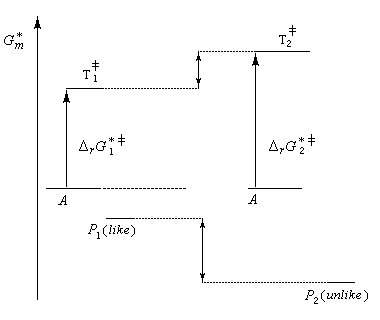
Le produit cinétique P1 est aussi le produit thermodynamique. Le produit cinétique P1 n'est pas le produit thermodynamique P2 - dans une synthèse énantiosélective, les produits ont la même enthalpie libre. Pour qu'un excès énantiomérique soit observé il faut opérer sous contrôle cinétique avec des états de transition diastéréo-isomères dont les enthalpies libres sont différentes.
Dans l'exemple ci-dessous, la formation à partir du même substrat A de l'énantiomère P1 (-) est plus rapide que celle de l'énantiomère P2 (+).
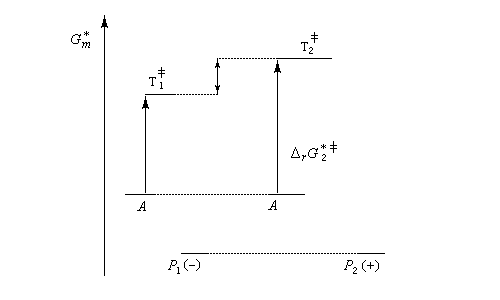
Réactions contrôlées par le substrat
Introduction
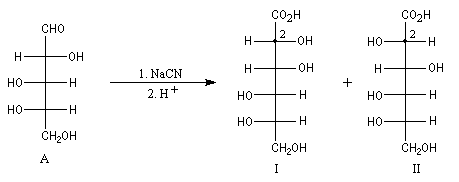
Un cas particulier d'induction asymétrique est l'influence exercée par un centre chiral sur le déroulement stéréochimique d'une réaction impliquant les faces diastéréotopiques d'une fonction insaturée située à proximité de ce centre chiral. Un exemple typique est l'influence exercée par un atome de carbone asymétrique adjacent à un groupe carbonyle. Les premiers exemples de ce type remontent aux travaux d'Emil Fischer lors de son étude des sucres de la famille du glucose (1894). Par addition d'ions cyanure suivie d'hydrolyse sur le L-arabinose, Fischer avait remarqué que seul l'acide mannonique I est obtenu à l'exclusion de son épimère, l'acide gluconique II. Il s'agit dans ce cas d'induction asymétrique 1,2 car le centre asymétrique inducteur est lié à celui qui est nouvellement créé.
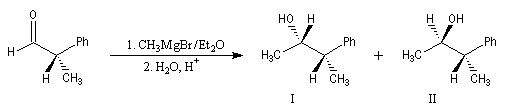
Règle de Cram
Raisonnons sur l'exemple de l'addition d'un réactif organométallique sur un substrat carbonylé. La molécule de départ est la (2R)-2-phénylpropanal. La molécule comporte un atome de carbone asymétrique adjacent au groupe carbonyle. La présence de ce centre chiral rend les faces du carbonyle diastéréotopiques. L'addition d'un nucléophile achiral sur chacune de ces faces conduit à deux composés diastéréoisomères 1 et 2 en proportions différentes. Il s'agit d'une réaction diastéréosélective.
|
Composé
|
I
|
II
|
|
% de produit
|
71
|
29
|
G > M > P
Le groupe G est placé le plus loin possible du groupe carbonyle c'est à dire dans une conformation antipériplanaire.
La règle de Cram s'appuie sur une base stérique. Le nucléophile va
réagir de façon préférentielle sur la face du carbonyle la plus dégagée
c'est
à dire celle qui contient le groupe le moins volumineux (P).
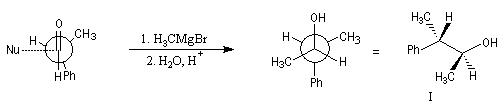
Modèle de Felkin
H. Felkin (1968) a proposé une justification de la règle de Cram à partir de considérations d'analyse conformationnelle.
Les groupes liés à l'atome de carbone asymétrique sont classés par taille décroissante :
G > M > P
Le carbonyle est placé perpendiculairement à G, tandis que le groupe R
est placé le plus loin de M. Le nucléophile attaque le carbonyle dans
une direction perpendiculaire. Cela correspond aux situations suivantes :
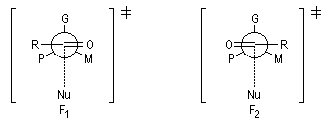

Modèle de Felkin-Anh
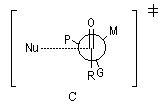
Le modèle de Felkin-Anh (1976), propose une approche plus fine que dans le modèle de Felkin. Dans ce dernier, le choix entre les états de transition F1 et F2 repose seulement sur les interactions au sein du substrat car toutes les distances faisant intervenir le nucléophile sont identiques. Dans le cas du modèle de Felkin-Anh le nucléophile intervient. Il réagit avec le carbonyle dans le demi-espace contenant P en respectant l'angle de Dunitz-Bürgi voisin de 105° (ou inférieur à cette valeur selon qu'il y a ou non assistance électrophile.) L'état de transition ci-dessous est favorisé car la trajectoire du nucléophile est celle qui passe au plus près du groupe P.
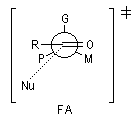
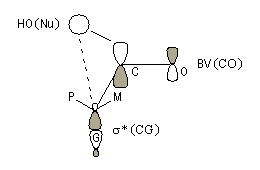 |
Justification orbitalaire du modèle de Felkin-Anh. Lors de l'approche
du nucléophile, les deux faces du carbonyle ne sont pas équivalentes.
En plus de l'interaction principale
entre la plus haute orbitale occupée par le nucléophile (HO) et la plus
basse orbitale vacante (BV) du carbonyle (trait plein), la disposition
perpendiculaire entre les liaisons CO et CG permet un recouvrement
secondaire favorable (pointillés) entre la HO du nucléophile et
l'orbitale antiliante s* de la liaison C-G (G est le groupe le plus "volumineux" ; voir plus bas.) [7]. Il s'agit donc d'un effet d'hyperconjugaison.
|
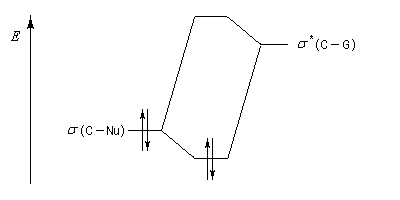
- l'encombrement effectif peut souvent être estimé au moyen des rayons de Van der Waals (mais pas toujours) ;
- le caractère attracteur du groupe lié à son caractère électronégatif.
Dans l'exemple suivant, NBn2 qui désigne le groupe amino protégé par un groupe benzyle, est traité comme un groupe G.
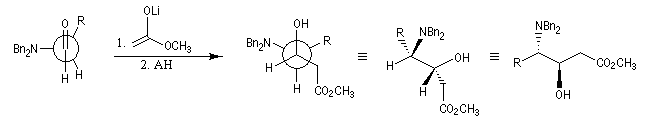
Angle de Flippin-Lodge
Considérons la réaction suivante :
La diastéréosélectivité augmente avec l'encombrement du groupe R
|
R
|
I (Felkin)
|
II (anti-Felkin)
|
|
H
|
71
|
29
|
|
Et
|
86
|
14
|
|
tBu
|
96
|
4
|
Opinion de D. A. Evans à propos de l'effet Cieplak :
"Structures are stabilized by stabilizing their highest energy filled states. This is one of the fundamental assumptions in frontier molecular orbital theory. The Cieplak hypothesis is nonsense." Prof. David A. Evans
Contrôle par chélation
La réaction suivante fournit avec une grande stéréosélectivité le stéréoisomère II (composé anti-Felkin).
|
Composé
|
I (Felkin)
|
II (anti-Felkin)
|
|
% de produit
|
5
|
95
|
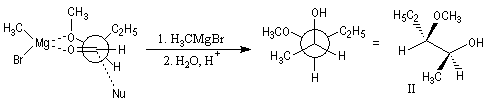
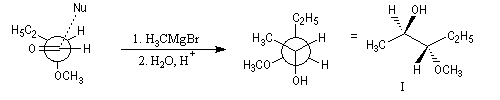
Le contrôle par chélation n'est pas possible lorsque la fonction éther comporte des groupes volumineux tels que TBS ou TBDPS dans les éthers de silyle.
La réaction suivante permet la préparation de diols 1,2 (après déprotection) avec une stéréochimie anti lorsque R est le groupe benzyle (Bn) et une stéréochimie syn lorsque c'est le groupe tertiobutylsilyle (TBS).
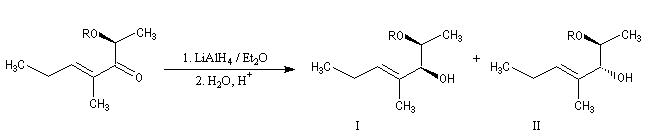
|
Composé
|
I (Felkin)
|
II (chélation)
|
|
R = Bn
|
2
|
98
|
|
R = TBS
|
95
|
5
|
remarque : les réactions d'addition nucléophile des hydrures sur le groupe carbonyle font l'objet d'un paragraphe spécifique dans le chapitre relatif aux composés carbonylés.
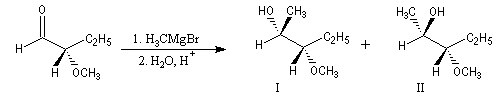
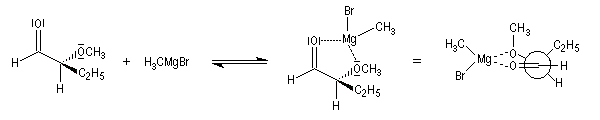
Règle de Prelog
La règle de Prelog est utilisée pour prévoir le sens de l'addition sur les faces prochirales d'un groupe carbonyle située en g d'un centre chiral [12]. L'exemple suivant concerne l'addition d'un organomagnésien sur un cétoester. Les groupes carbonyles sont placés en position antiparallèle. Le groupe le plus volumineux (G) est placé dans le plan de figure. L'organométallique attaque le carbonyle dans le demi-plan contenant le groupe le moins volumineux (P).
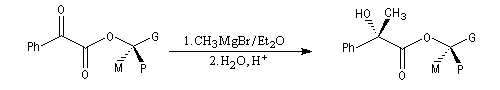
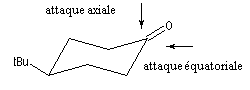
L'exemple choisi concerne l'addition des hydrures non encombrés sur les cétones cycliques. Elle s'effectue de façon préférentielle par le biais d'une attaque axiale de l'ion hydrure. Après hydrolyse, l'alcool majoritaire est celui dont le groupe -OH et situé en position équatoriale.
La 4-tertiobutylcyclohexanone fournit un bon modèle pour cette réaction car le basculement conformationnel est bloqué du fait de la présence du volumineux groupe tertiobutyle. Les résultats sont les suivants :
|
Composé
|
A1
|
A2
|
|
LiAlH4
|
92
|
8
|
|
LiBH(secBu)3
|
7
|
93
|
|
Synthèses diastéréosélectives mettant à profit un auxilliaire chiral
Généralités
La synthèse stéréosélective à partir de substrats et de réactifs achiraux est possible à condition d'utiliser un auxilliaire chiral. Ce dernier est lié de façon covalente au substrat puis détaché de ce dernier. Les avantages sont :
- la formation de diastéréoisomères facilement séparables ;
- une diastéréosélectivité généralement élevée.
- la fixation de l'auxilliaire sur le substrat puis son enlèvement ajoutent deux réactions supplémentaires à la synthèse ;
- la stéréosélectivité n'est pas toujours facile à prévoir.
La préparation de dérivés acylés d'oxazolidinones substituées a été vue dans le chapitre consacré aux dérivés d'acides. Très récemment, des oxazolidonones chirales ont été préparées avec de très bons excès énantiomériques en mettant à profit la réaction d'aminohydroxylation énantiosélective de Sharpless. Par action du LDA, on obtient essentiellement l'énolate Z.

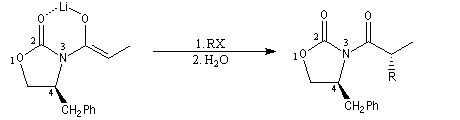
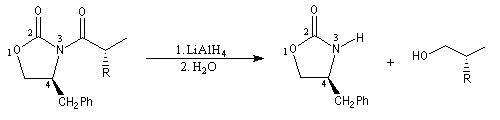
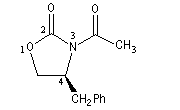 |
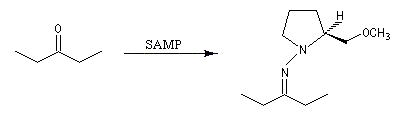
Cette méthode due à D. Enders est basée sur la formation d'hydrazones à partir de composés carbonylés [24]. SAMP est le sigle désignant la (S)-1-amino-2-méthoxyméthylpyrrolidine. Son énantiomère, la (R)-1-amino-2-méthoxyméthylpyrrolidine est noté RAMP. Le SAMP est préparé à partir de la (S)-hydroxyméthylpyrrolidine et le RAMP à partir de l'acide glutamique naturel [26].
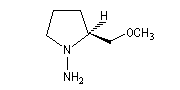 |
L'exemple suivant concerne la synthèse d'une substance de défense d'une araignée ("Daddy-long-legs Spider"). L'excès énantiomérique est supérieur à 95 %.
- formation de l'hydrazone ;
- métallation par le LDA à basse température ;
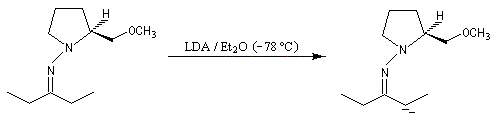
- alkylation de l'anion ;
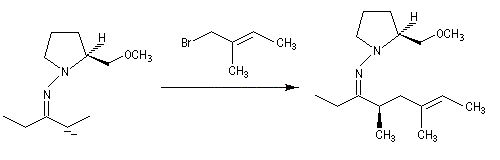
- clivage de l'intermédiaire.
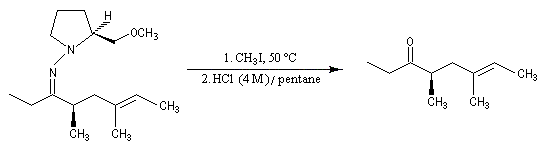
- RAMP et SAMP sont des produits commerciaux, donc facilement accessibles ;
- la réaction est généralisable à pratiquement tous les carbonylés sauf ceux qui présentent un encombrement très important ;
- la déprotection est facile.
- iodure de méthyle dans HCl ce qui exclut la présence d'un groupe amino ;
- utilisation de l'ozone mais cela exclut la présence de liaisons éthyléniques qui sont clivées par l'ozone.
Dans cette méthode due à D. Seebach [15], on cherche à réaliser la transformation suivante.
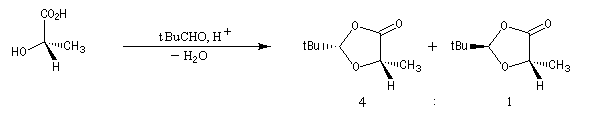
Généralités
La chiralité est introduite via le réactif. Il n'y a plus besoin des étapes de fixation et de décrochage de l'auxilliaire.
Hydrures modifiés
L'alpine borane (réactif de Midland symbolisé par AB) ou le chloroborane de Brown sont des réactifs appartenant à la famille des hydrures de bore neutres (tout comme BH3 ou le DIBAL pour les hydrures d'aluminium). Ils permettent des réductions énantiosélectives de composés carbonylés.
L'exemple suivant concerne la réduction du groupe carbonyle d'un cétoester. L'atome d'hydrogène est transféré sur la face prochirale re du groupe carbonyle conduisant au composé de configuration absolue S avec un excès énantiomérique de 100 %.
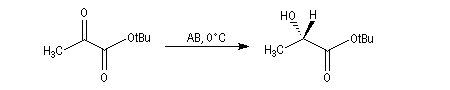
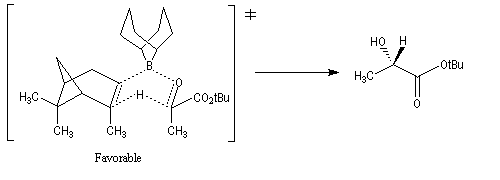
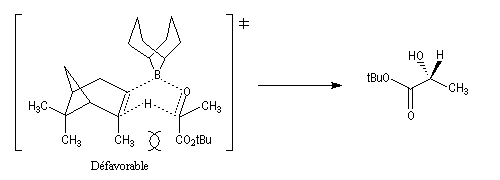
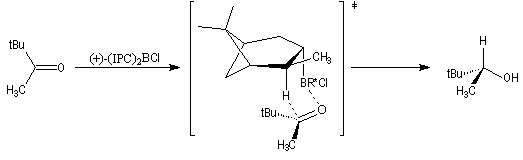
Ce sujet a été étudié dans le chapitre consacré aux composés éthyléniques.
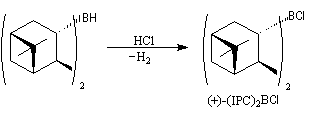
Le diisopinocamphéylborane Ipc2BH est le premier réactif de ce type introduit par H. C. Brown en 1961. Il permet de bons excès énantiomériques à partir de composés éthyléniques de stéréochimie cis.
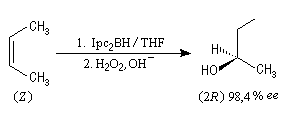
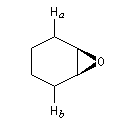
L'utilisation d'une base chirale dérivée de la (S)-proline a permis au chimiste japonais M. Asami d'obtenir de très grands excès énantiomériques pour la déprotonation d'époxydes méso [16]. Dans l'époxyde suivant, qu'on peut considérer comme un dérivé du cyclohexène, les atomes d'hydrogène Ha et Hb sont énantiotopiques.
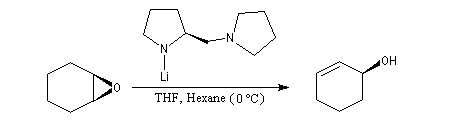

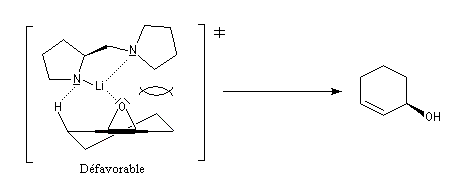
Un autre exemple de déprotonation énantiosélective concerne la réaction entre le butyllithium complexé par la spartéine sur un dérivé de la pyrrolidine.
Catalyse énantiosélective
Généralités
Le catalyseur intervient dans l'état de transition afin de disposer réactif et substrat dans une géométrie préférentielle. Cette façon de procéder offre beaucoup d'avantages par rapport aux méthodes précédentes. Seul le catalyseur est nécessairement chiral. Il est utilisé en faible quantité et il peut être facilement séparé du milieu réactionnel par chromatographie. Le premier exemple de ce type fut rapporté par Betti et Luchi en 1940. Il s'agissait de la réaction entre un composé organométallique, l'iodure de méthylmagnésium et le benzaldéhyde en présence de N, N-diméthylbornylamine.
La première réaction stéréosélective utilisant un catalyseur métallique chiral soluble permettant de discriminer les faces prochirales d'un substrat a été rapportée par R. Noyori en 1966 [13].
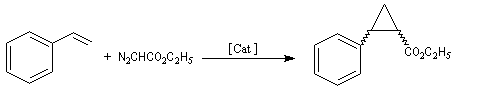
Voici l'exemple de la synthèse d'un précurseur des vitamines E et K à partir du nérol, un alcool allylique. L'excès énantiomérique est : ee = 98 % [25].
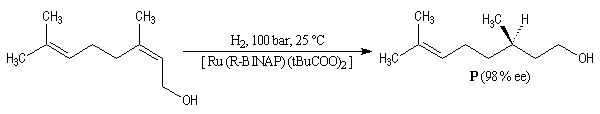
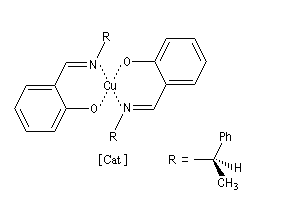
Le ligand BINAP introduit par R. Noyori, existe sous deux formes énantiomères atropisomères. Le aR-BINAP est l'un des constituants
d'un catalyseur homogène au ruthénium utilisé dans les réactions d'hydrogénation énantiosélectives.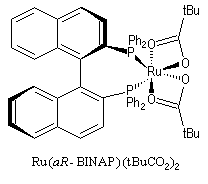
|
Un autre exemple d'utilisation de l'hydrogénation énantiosélective catalysée par un complexe chiral soluble est celui de la synthèse par W. S. Knowles de la (L)-DOPA, un médicament actif vis à vis de la maladie de Parkinson. Isomérisation énantiosélective
Les catalyseurs de Noyori peuvent également être utilisés pour promouvoir des réactions d'isomérisation. Un exemple est fourni par une étape de la synthèse industrielle du (-)-menthol à partir du myrcène, selon un procédé mis au point par des chercheurs de la firme japonaise Takasago [23]. Ce procédé fournit actuellement environ 30 % du marché mondial du (-)-menthol.
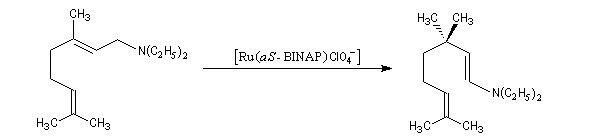
- L'époxydation de Sharpless concerne les alcools allyliques.
- L'époxydation de Jacobsen est réalisable sur les composés éthyléniques ordinaires.
K. B Sharpless 1987. La dihydroxylation énantiosélective des doubles liaisons éthyléniques.
Aminohydroxylation énantiosélective (AA)
K. B Sharpless 1996. L' aminohydroxylation énantiosélective des doubles liaisons éthyléniques.
Réaction de Corey-Bakshi-Shibata Cette réduction énantiosélective de composés carbonylés prochiraux utilise comme catalyseur une oxazaborolidine comme catalyseur. Elle est étudiée dans le chapitre consacré aux composés carbonylés.
Amplification chirale
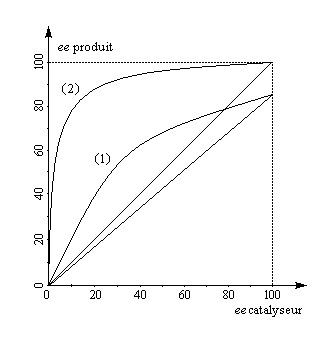
La plupart du temps, lors d'une catalyse ou d'une autocatalyse énantiosélectives, l'excès énantiomérique du produit ee (p) est proportionnel à celui du catalyseur ee (c).
- un effet non linéaire positif produit davantage de produit que lorsque la relation de proportionalité s'applique ;
- l'effet non linéaire est négatif dans le cas contraire.
Selon la réactivité du complexe méso TiLRLS par rapport aux complexes chiraux TiLSLS et TiLRLR un effet non linéaire positif ou négatif peut-être observé.
|
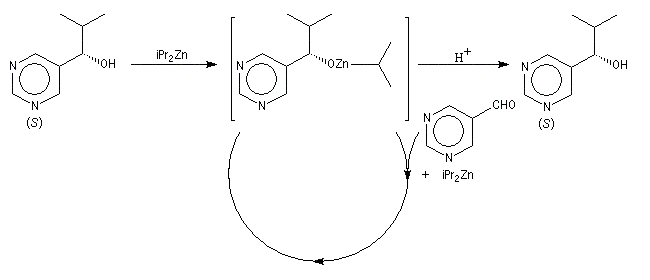
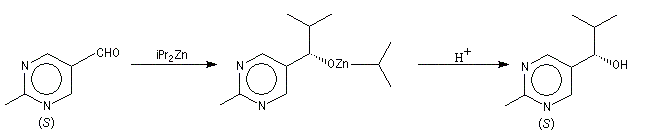
Un exemple d'amplification chirale mis en évidence par R. Noyori concerne l'addition énantiosélective des dialkylzinciques sur les aldéhydes aromatiques.
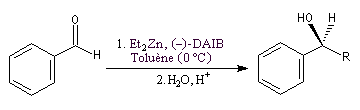
|
Dans ce cas, le produit chiral formé sert de catalyseur pour sa propre synthèse. Il est mis en quantité catalytique au début de la synthèse.
Ouvrages théoriques
J. March, Advanced organic chemistry, Wiley Interscience.
F. A. Carey, R.J. Sundberg, Advanced organic chemistry, 3d edition (Plenum Press, 1990).
H. Kagan, La stéréochimie organique (PUF, 1975).
J. L Pierre Principes de stéréochimie organique statique (A. Colin, 1971).
André Collet, Jeanne Crassous, Jean-Pierre Dutasta, Laure Guy, Molécules chirales : stéréochimie et propriétés (Editions du CNRS, 2006)
Nguyên Trong Anh, Orbitales frontières : manuel pratique, EDP Sciences, CNRS.
Erick M. Carreira, Lisbet Kvaerno, Classics in Stereoselctive Synthesis, J. Wiley, 2009.
J. Seyden-Penne, Synthèse et catalyse asymétriques, (CNRS éditions, 1994).
R.E. Gawley, J. Aubé, Principles of Asymmetric synthesis, Pergamon, 1996.
K. Mislow, Introduction to stereochemistry (W. A Benjamin, New York).
J. Jacques, La molécule et son double (Hachette, 1992).
Morrison, James D.; Mosher, S. Harry : Asymmetric organic réactions, Prentice-Hall, Englewood Cliff, New Jersey, 1971.
Articles
[1] E. L. Eliel et F. J. Biros, J. Am. Chem. Soc. 88, 3334 (1966).
[2] V. Pellegrin - Les représentations graphiques bidimensionnelles des molécules en chimie organique (Bulletin de l'Union des Physiciens, février 1999). [3] D. Y. Curtin, Rec. Chem. Prog. 15, 111 (1954).
[4] Unambiguous specification of stereoisomerism about a double bond, J. E. Blackwood et coll. J. am. Chem. Soc., ,90, 509, (1968). (utilisation des descripteurs Z et E)
[5] D. J. Cram et F. A. Abd Elhafez, J. am. Chem. Soc., 74, 5828 (1952).
[6] M. Cherest, H. Felkin, N. Prudent, Tetrahedron lett.,1968, 18, 2199, 2204.
[7] N. T. Anh, O. Eisenstein Tetrahedron lett.,1976, 155.
[8] K. Soai. Nature 1295, 378, 767.
[9] K. Soai. Tetrahedron : Asymmetry, 1997, 8, 1717.
[10] R. Noyori et al J. am. Chem. Soc., 111, 9134-9135 (1989).
[11] R. Noyori et al J. Am. Chem. Soc, 108, 6071, 1986.
[12] Prelog. V, Helv. Chim. Acta. 1953, 36, 308.
[13] Nozaki, H. ; Moriuti, S. ; Takaya, H. ; Noyori, R. , Tetrahedron lett.,1966, 6239.
[14] Chemistry and Engeneering news, octobre 1997.
[15] D. Seebach Tetrahedron 1984, 40, 1313.
[16] M. Asami, T. Ishizaki, S. Inoue, Tetrahedron, Asymmetry, 1994, 5, 5, 793.
[18] H. B. Kagan, J. C. Fiaud. Top. Stereochem. 1988, 18,249-330
[19] Victor S. Martin, S. Woodard, Tsutomu Katsuki, Yasuhiro Yamada, Masonari Ikeda, K. Barry Sharpless, J. Am. Chem. Soc., 1981, 103 (20), pp 6237-6240
Liens
[20] Catalytic Enantioselective Additions of Dialkyl Zincs to Aldehydes using (2S)-DAIB) by Masato Kitamura, Hiromasa Oka, Seiji Suga, and Ryoji Noyori.
[23] (-)-menthol from myrcène
[24] Asymmetric syntheses using the SAMP/RAMP method by Dieter Enders, Helmut Kipphardt, and Peter Fey
[25] Asymmetric Hydrogenation of Allylic Alcohols using BINAP-Ru Complex by R. Noyori and Coll
[26] SAMP and RAMP versatile chiral auxiliaries by Dieter Enders, Peter Fey, and Helmut Kipphardt
[28] .
[29] Preparation of s-methylglycidate via hydrolytic kinetic resolution by Christian P. Stevenson, Lars P. C. Nielsen, and Eric N. Jacobsen
[31] Perspectives offertes sur la synthèse asymétrique par H. Kagan
[31] Substitutions nucléophiles énantiosélectives sur des aziridines meso par P. Nury
[31] (R-(-)-10-methyl-1(9)-octal-2-one by G. Revial and M. Pfau
[31] Diastéréosélective aldol condensation by James R. Gage and David A. Evans
[31] Transformation of pseudoephedrine amides into highly enantiomerically enriched aldehydes, alcohols and ketones by Andrew G. Myers, Bryant H. Yang, and Hou Chen.
[31] Asymmetric Synthesis of a-amino acids by the alkylation of pseudoephedrine glycinamide : L-allylglycine and N-boc-L-allylglycine by Andrew G. Myers and James L. Gleason.
[31] Felkin-Anh model and chelation control
[31] Synthese de liaisons CC
[31] Termes généraux de la chimie (Journal Officiel 3 juillet 1996)
[31] Thèse S. Malfait
[31] Thèse Delacroix
[31] Dynamic Kinetic Resolution, Pratical Applications in Synthesis By Valerie Keller, November 1, 2001
[31] The Cieplak effect by Simon Meek
[31] The evolution of Stereochemical Models for CO additions by D. A. Evans, Harvard University.

Aucun commentaire:
Enregistrer un commentaire