Cours de chimie Organique -
Les alcools
Introduction
Nomenclature
On appelle alcool un composé dans lequel un groupe caractéristique hydroxyle -OH est lié à un atome de carbone saturé.
La chaîne principale est la chaîne la plus longue qui porte le groupe -OH. La numérotation de la chaîne est choisie de façon que le groupe -OH ait le numéro le plus petit. Le nom de l’alcool est formé en ajoutant le suffixe ol au nom de l’hydrocarbure possédant le même nombre d’atomes de carbone que la chaîne principale.
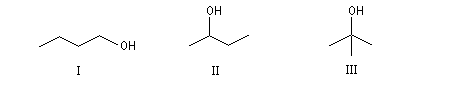
Les trois alcools suivants ont pour formule C4H10O. Ce sont des isomères de position.
I
|
II
|
III
|
Butan-1-ol
|
Butan-2-ol
|
2-Méthylpropan-2-ol
|
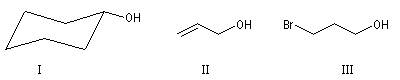
La chaîne carbonée peut être insaturée, si l’insaturation n’affecte pas l’atome de carbone portant le groupe hydroxyle.
I
|
II
|
III
|
Cyclohexanol
|
Prop-2-ène-1-ol
|
3-Bromopropan-1-ol
|
Classe
Selon que l'atome de carbone portant le groupe caractéristique -OH est lié à 1, 2, 3 atomes de carbone, l'alcool est qualifié de primaire, secondaire, tertiaire. Le butan-1-ol, le butan-2-ol, le 2-méthylpropan-2-ol sont des isomères de position de formule brute C4H10O appartenant aux trois classes.
Alcool
|
butan-1-ol
|
butan-2-ol
|
2-méthylpropan-2-ol
|
Classe
|
I
|
II
|
III
|
Beaucoup d'alcools existent à l'état naturel. Le méthanol était obtenu autrefois par distillation du bois. L'éthanol se forme par fermentation des jus sucrés. Le (10E, 12Z)-hexadéca-10,12-diène-1-ol ou bombykol est une phéromone sexuelle du bombyx qui a été isolée en 1959 par J. Butenandt.
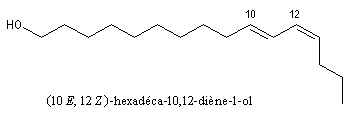
Le menthol est l'un des constituants de l'essence de menthe. Le cholestérol est le représentant le plus connu d'une famille de composés extrêmement importants en biochimie : les stéroïdes.
Le (E)-3,7-diméthyl-2,6-octadién-1-ol ou géraniol est un alcool terpénique présent dans l'essence de géranium.
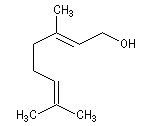 Le (Z)-3,7-diméthyl-2,6-octadién-1-ol, diastéréoisomère du précédent est le nérol.
Le (Z)-3,7-diméthyl-2,6-octadién-1-ol, diastéréoisomère du précédent est le nérol.
|
Méthanol CH3OH
C'est l'alcool dont le tonnage produit est le plus grand.
| Le méthanol est produit par addition entre H2 et CO.
Les produits dérivés sont les suivants : 50 % méthanal, 10 % diméthyltéréphtalate (fibres polyesters), 10 % méthyltertiobutyléther MTBE (additif pour carburant), 6 % acide éthanoïque (par carbonylation avec CO), 13 % divers (méthylamine, chlorométhane, méthylméthacrylate). |
 |
L'éthanol peut être obtenu par fermentation de sucres. Une autre voie d'accès est la synthèse à partir de l'éthène qui représente 30 % de la production en Europe et 60 % aux USA.
.
Il est utilisé en tant que solvant, pour la synthèse de dérivés halogénés et d'éthanoate d'éthyle. |
 |
Le cyclohexanol est obtenu par hydrogénation du phénol.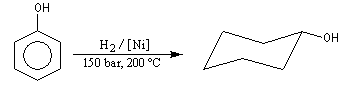 Son oxydation en acide adipique (hexanedioïque) est une étape de la synthèse du Nylon 6-6. |
Propriétés physiques
Caractéristiques géométriques et énergétiques
Par définition, l'atome de carbone fonctionnel est lié par des liaisons simples qui se développent selon les directions d'un tétraèdre. L'atome d'oxygène contracte deux liaisons simples respectivement avec l'atome de carbone et l'atome d'oxygène. La géométrie localement plane autour de l'atome d'oxygène dérive d'un arrangement tétraédrique des paires d'électrons. Puisque les paires non liantes occupent en moyenne un volume plus grand que les paires liantes, on prévoit un angle entre les liaisons a < 109°. Le tableau suivant regroupe quelques valeurs moyennes de grandeurs géométriques et énergétiques.
d (C-O) (nm)
|
d (O-H) (nm)
|
a (COH) (°)
|
Do (C-O) (kJ.mol-1)
|
Do (O-H) (kJ.mol-1)
|
0,143
|
0,096
|
106
|
343
|
463
|
Alcool
|
Constante diélectrique er
|
Moment dipolaire m (D)
|
| Méthanol |
32,6
|
1,71
|
| Ethanol |
24,3
|
1,68
|
Le tableau suivant regroupe les températures de changement d'état de quelques alcools courants.
Nom de l’alcool
|
TF (°C)
|
TE (°C)
|
Densité d
|
| méthanol |
-97
|
64,7
|
0,792
|
| éthanol |
-114
|
78,3
|
0,789
|
| propan-1-ol |
-126
|
97,2
|
0,804
|
| propan-2-ol |
-88
|
82,3
|
0,786
|
| butan-1-ol |
-90
|
117,7
|
0,810
|
| 2-méthylpropan-2-ol |
2
|
82,5
|
0,789
|
| hexan-1-ol |
-52
|
155,8
|
0,820
|
| dodécanol |
24
|
259
|
0,831
|
Composé
|
propane (M = 44 g.mol-1)
|
éthanol (M = 46 g.mol-1)
|
Température d'ébullition
|
- 42 °C
|
78,5 °C
|
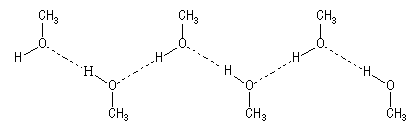
Les alcools en tant que solvants
Du fait de la présence du groupe -OH, les alcools jusqu'à 5 atomes de carbone sont très solubles dans l'eau avec laquelle ils s'associent par liaisons hydrogène. L'éthanol est miscible à l'eau en toute proportions. Le mélange n'a pas un caractère idéal et il s'effectue avec contraction de volume et dégagement de chaleur. Notons qu'il est impossible de préparer l'alcool absolu (100 % en éthanol) par distillation du mélange éthanol-eau car il existe un azéotrope positif (à point d'ébullition minimum) pour une teneur de 95 % en alcool.
L'éthanol et le méthanol dissolvent également assez bien certains composés ioniques. Comme ils sont miscibles à de nombreux composés organiques on les utilise fréquemment en synthèse organique comme solvants, par exemple dans des réactions de substitutions ou le nucléophile est un ion halogénure.
Spectroscopie
Spectroscopie infrarouge
Le spectre suivant est celui de l'hexan-1-ol. Il est typique du spectre infrarouge d'un alcool pur.
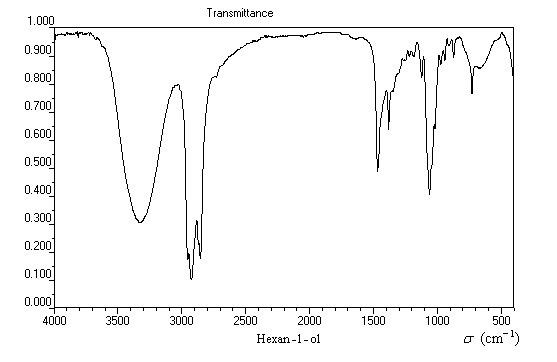
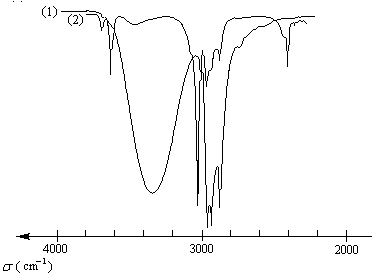 |
Influence de la nature du solvant sur le nombre d'onde de la vibration de valence de la liaison O-H :
|
Liaisons hydrogène intramoléculaires : dans certaines molécules comme celles de polyols on observe des liaisons hydrogène intramoléculaires. Il est facile de distinguer les liaisons intermoléculaires et les liaisons intramoléculaires par spectroscopie infrarouge. Par dilution dans un solvant comme CCl4, la bande d'absorption due aux premières disparaît mais pas celle due aux secondes.
Spectroscopie de RMN
Le spectre de RMN de l'éthanol très pur (éthanol absolu) effectué à haute résolution présente trois groupes de protons de déplacements chimiques différents. C'est un système A3M2X. Les protons du méthylène -CH2 - (M2) sont couplés à la fois avec ceux du méthyle -CH3 (A3) et le proton du groupe -OH (X).
Groupe de protons
|
CH3 (A3)
|
CH2 (M2)
|
H (X)
|
Signal
|
triplet
|
quadruplet dédoublé
|
triplet
|
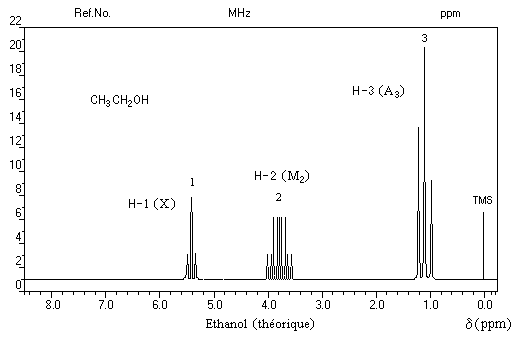
Groupe de protons
|
CH3 (A3)
|
CH2 (M2)
|
H (X)
|
Signal
|
triplet
|
quadruplet
|
singulet
|
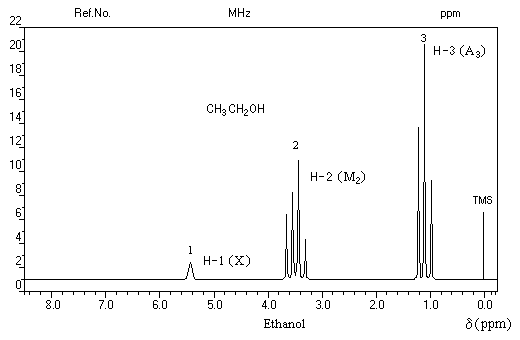
Une technique de simplification consiste à ajouter quelques gouttes d'eau lourde D2O. On observe alors l'équilibre :
En revanche on peut observer un signal dû au proton du groupe -OH sous forme de multiplet dans une structure possédant une liaison hydrogène intramoléculaire. L'échange du proton qui partage son affinité entre deux sites est suffisamment ralentie vis à vis du phénomène RMN pour que le couplage redevienne observable comme dans la structure ci-dessous :
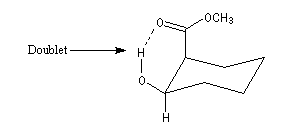
Réactions d'oxydo-réduction
Réactifs usuels impliquant des éléments de transition
Les oxydants les plus classiques sont ceux qui impliquent des dérivés oxygénés de métaux de transition.
- Les dérivés du Cr (VI) sont souvent
utilisés. Les ions dichromate en milieu acide sont des oxydants
puissants qui peuvent être mis à profit dans le dosage des alcools.
E0(Cr2O72-/Cr3+) = 1,33 V. Malheureusement, leur toxicité limite leur emploi [2]. - Les ions permanganate MnO4- : E0 (MnO4-/Mn2+) = 1,51 V sont utilisables mais ils sont peu chimiosélectifs et oxydent d'autres fonctions [11].
- Les ions ferrate FeO42-, stables dans un domaine restreint de pH en milieu très basique, peuvent également constituer des réactifs intéressants d'oxydation : E0 (FeO42-/Fe3+) = 2,2 V [12].
 |
Le dichromate de potassium est un solide de couleur orange. Il est dissous dans une solution d'acide sulfurique. Le volume est complété par de l'eau distillée. Les composés du Cr (VI) sont dangereux. Il présentent malheureusement la propriété d'induire certains cancers. Comme l'absorption par voie cutanée constitue le risque principal, il est indispensable d'utiliser des gants pour manipuler ces composés. On peut effectuer le dosage de l'éthanol en le faisant réagir avec un volume connu de solution titrée de dichromate de potassium en excès ce qui permet de rendre la réaction d'oxydation quantitative. Le dichromate restant est réduit par une solution titrée de sel de Mohr. |
Intéressons-nous à l'oxydation de 3 des 4 alcools isomères de formule brute C4H10O appartenant à chaque classe : le butan-1-ol, le butan-2-ol et le 2-méthylpropan-2-ol.
 |
Les deux tubes de gauche contiennent respectivement du butan-1-ol et une solution de dichromate de potassium dans l'acide sulfurique. Dans le tube de droite, on a introduit une petite quantité d'alcool dans la solution de dichromate de potassium. Une coloration bleu-vert se développe qui témoigne de la réduction des ions Cr2O72- en ions Cr3+. |
 |
Dans le tube où s'est déroulée l'oxydation, on a ajouté
une petite quantité de pentane. Après agitation, le butanal formé par
oxydation de l'alcool se concentre dans cette phase organique (phase
supérieure). Quelques mL de la phase organique surnageante sont ajoutés dans deux autres tubes :
|
Alcool
|
butan-1-ol
|
butan-2-ol
|
2-méthylpropan-2-ol
|
Vitesse
|
rapide à froid
|
lente à froid
|
-
|
Produit
|
butanal
|
butanone
|
-
|
Classe
|
primaire
|
secondaire
|
tertiaire
|
Produit d'oxydation
|
aldéhyde
|
cétone
|
-
|
Remarque : le 2-méthylpropan-2-ol est solide à la température ordinaire. Lorsqu'on veut réaliser des réactions tests avec cet alcool il ne faut pas utiliser les quelques gouttes de liquide obtenues en retournant la bouteille. En effet il peut s'agir des impuretés présentes dans le composé.
Le mécanisme de l'oxydation chromique des alcools a été étudié sur l'exemple de l'alcool isopropylique par Westheimer. Il y a formation réversible d'un ester chromique.
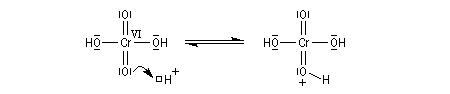
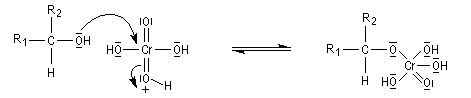
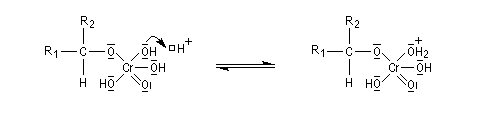
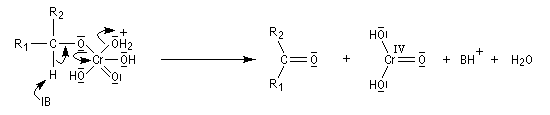
L'oxydation des alcools secondaires conduit aux cétones. Le réactif de Jones est un réactif souvent employé (on dissout 26,72 g de CrO3 dans 23 mL de H2SO4 concentré puis on étend avec de l'eau jusqu'à un volume de 100 mL).
Ainsi, le cyclohexanol est aisèment oxydé en cyclohexanone par le réactif de Jones.
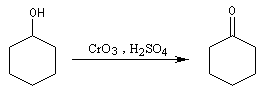
L'oxydation d'un alcool primaire conduit, dans un premier temps, à un aldéhyde. Mais les aldéhydes étant des réducteurs forts il faut prendre des précautions spéciales pour s'arrêter à ce stade. Un certain nombre de techniques sont utilisables.
Les aldéhydes sont généralement plus volatils que les alcools parents car ils ne forment pas de liaison hydrogène. Il est parfois possible de distiller l'aldéhyde au fur et à mesure de sa formation ce qui a pour effet de supprimer le contact avec l'oxydant.
On peut ainsi préparer le butanal par oxydation du butan-1-ol avec Na2Cr2O7 en présence d'acide sulfurique. Le rendement n'est cependant pas très bon.
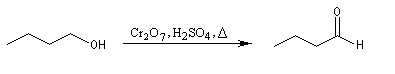
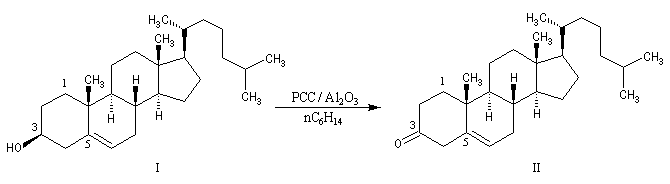
L'étude du mécanisme de la réaction d'oxydation des aldéhydes montre que celle-ci passe par la formation d'un ester chromique qui implique l'hydrate du carbonylé (composé d'addition entre le carbonylé et l'eau). L'idée est d'éviter la formation de cet hydrate en opérant en l'absence d'eau. Le chlorochromate de pyridinium PCC sur alumine ou le dichromate de pyridinium (PyNH+)2 Cr2O72- (PDC) sont des réactifs de choix dans de telles oxydations.
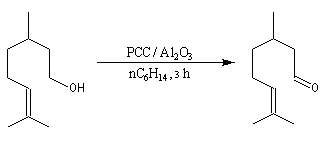
- L'utilisation du complexe CrO3Py2 a été préconisée par L. H. Sarett dans les années 50. Ce réactif oxyde les alcools secondaires en cétones mais il rencontre un peu moins de succès dans l'oxydation des alcools primaires en aldéhyde sans suroxydation.
- Une amélioration du réactif a été proposée par J. C. Collins. Elle consiste a utiliser le complexe CrO3Py2 dans le dichlorométhane. Avec ce nouveau réactif, l'oxydation des alcools primaires s'arrête au stade de l'aldéhyde. Un mode opératoire est le suivant : mélanger 1,2 g de CrO3 en agitant avec 1,9 g de pyridine dans 30 mL de CH2Cl2 sec. La solution est ensuite agitée jusqu'à ce que tout CrO3 soit dissous. La solution rouge foncé est refroidie vers 10 °C avant l'emploi. La synthèse de l'heptanal à partir de l'heptan-1-ol constitue un exemple de l'utilisation de ce réactif [23].
- Plus récemment Corey a proposé d'utiliser le chlorochromate de pyridinium : PyH+ClCrO3- (PCC réactif de Corey-Suggs) dont on trouvera un mode de préparation ci-dessous.
- Le dichromate de pyridinium : (PyNH+)2 Cr2O72- (PDC réactif de Corey-Schmidt) est aussi un réactif utile appartenant à la même catégorie que le PCC [3]. Il présente l'avantage d'être moins acide que PCC.
 |
Le chlorochromate de pyridinium C5H5NH+ClCrO3- ou PCC, introduit par le chimiste américain E. J. Corey, est un réactif souvent utilisé (12 g de CrO3
dans 22 mL de HCl 6 M on ajoute 9,5 g de pyridine pendant 10 min en
maintenant la température à 40 °C. On refroidit le mélange à 0 °C . Le
produit cristallise. Il est séché sous vide pendant 1 h). PCC est également utilisé sur alumine (chauffer la solution précédente vers 40 °C jusqu'à ce que le solide se dissolve. Ajouter 100 g d'alumine en agitant. Evaporer le solvant avec un évaporateur rotatif. Sécher sous vide pendant 2 h à la température ambiante). L'avantage de PCC sur alumine tient à la grande facilité de récupération du produit d'oxydation [3]. |
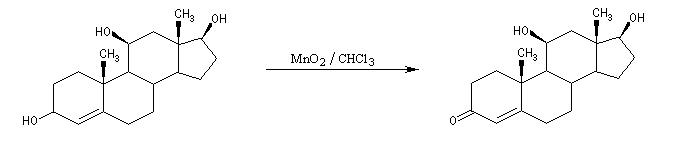
Les alcools allyliques et benzyliques sont plus réactifs que les alcools saturés (une manifestation de la mobilité protonique en position allylique). Ils sont oxydés par le dioxyde de manganèse MnO2 dans des conditions douces. On obtient des aldéhydes a, b-insaturés. A partir du rétinol (vitamine A) on peut ainsi obtenir le rétinal, un composé important dans la chimie de vision.
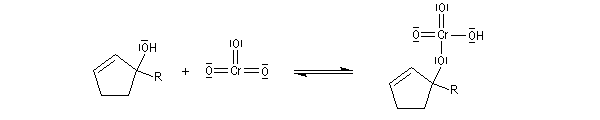

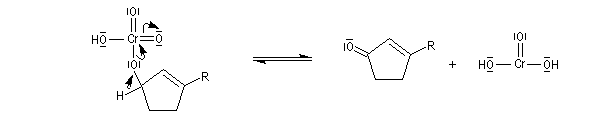
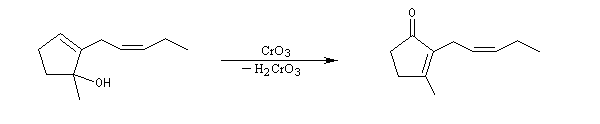
En milieu biologique, l'oxydation des alcools fait intervenir des enzymes appelées alcool-déshydrogénases. Le transfert des équivalents réducteurs vers le substrat est assuré par des coenzymes dont le plus important est le système NAD+/NADH.
NAD+ peut fixer un ion hydrure c'est à dire l'équivalent d'un ion H+ et de 2 électrons. La demi-équation électronique s'écrit :
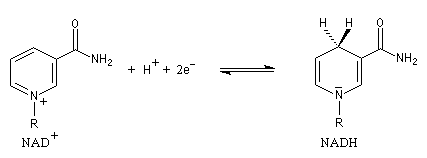
Notons que l'oxydation d'un alcool nécessite une base pour arracher un atome d'hydrogène de l'alcool.
L'oxydation d'un alcool chiral par NAD+ est une réaction énantiosélective. Dans l'oxydation du deutérioéthanol de configuration absolue S par NAD+ on obtient de l'éthanal deutérié tandis que l'atome d'hydrogène est retrouvé dans NADH.
Inversement, en présence d'une enzyme spécifique, NADH est capable de transférer l'atome d'hydrogène prochiral pro-R sur la face prochirale re de l'éthanal.
| Le nicotinamide adénine dinucléotide est un coenzyme de type soluble. Il est fixé à l'enzyme pendant la réaction puis est libéré. Une seconde réaction indépendante régénère le coenzyme. Notons que NAD+ est un composé aromatique. En revanche NADH ne l'est pas. Le passage de NAD+ à NADH correspond donc à une diminution de la stabilité du système. |
La synthèse du méthanal s'opère par oxydation du méthanol par l'oxygène de l'air.
L'oxydation de l'éthanol avec le cuivre comme catalyseur conduit à l'éthanal.
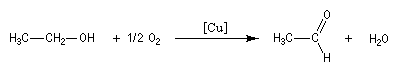
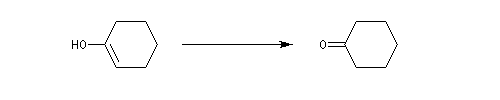
Dans des conditions assez vigoureuses, les alcools secondaires cycliques sont oxydés en cétones qui s'oxydent à leur tour avec rupture de la chaîne carbonée. L'oxydation de la cétone s'effectue par l'intermédiaire de la forme tautomère énol. L'oxydation du cyclohexanol par l'acide nitrique, permet la synthèse de l'acide hexane-1,6-dioïque encore appelé acide adipique [3].
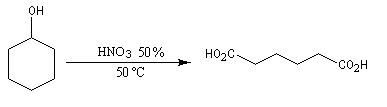
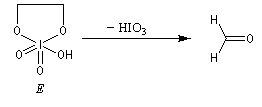
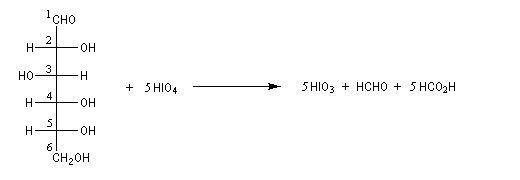
Coupure des a-glycols
Les diols 1,2 sont couramment appelés a-glycols. Rappelons quelques voies d'accès à ces composés :
- Dihydroxylation des doubles liaisons éthyléniques par le permanganate de potassium ou le tétroxyde d'osmium.
- Ouverture des époxydes par l'eau ou les ions hydroxyde.
- Réduction duplicative des composés carbonylés.
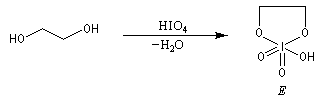
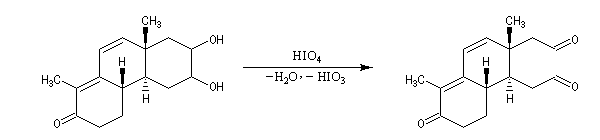
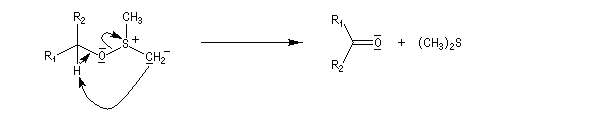
Oxydations utilisant le DMSO activé
Le DMSO est largement utilisé en tant que solvant dipolaire aprotique dans de nombreuses synthèses organiques. L'atome de soufre possède un caractère électrophile qui est mis en évidence par la forme mésomère de droite :
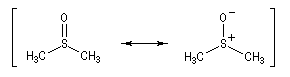
La réaction d'oxydation d'un alcool comporte les étapes suivantes :
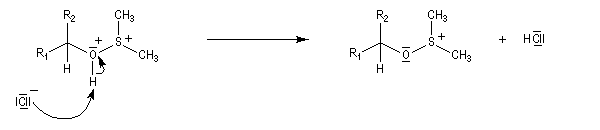
- Formation du réactif de Swern.
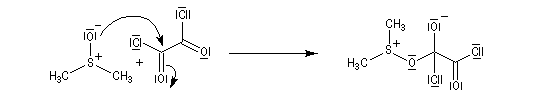
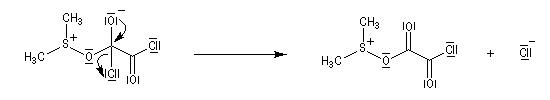
- Réaction entre le DMSO activé et l'alcool primaire ou secondaire à - 65 °C. Le soufre est devenu suffisamment électrophile pour réagir avec l'atome d'oxygène de l'alcool.
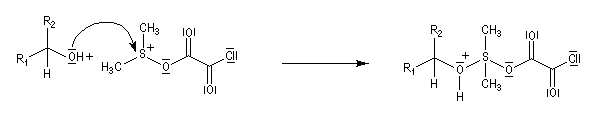

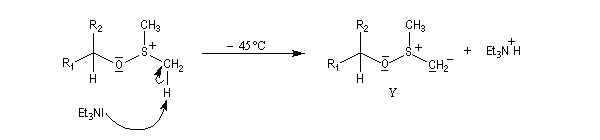
- Le sulfurane obtenu se décompose en sel de sulfonium. La force motrice de cette réaction est la formation de petites molécules stables.
- Le sel de sulfonium, traité par une base comme la triéthylamine conduit à l'ylure de sulfonium Y.
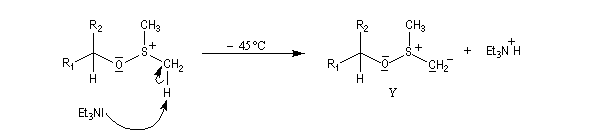
- Cet ylure subit une réaction d'élimination intramoléculaire pour donner le composé carbonylé.
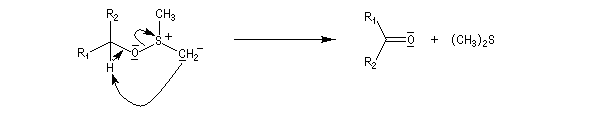
Mais si la température est trop élevée, on observe des réactions parasites comme la formation de thiocétal à la suite de la transposition de l'ylure d'alkoxysulfonium.
Voici quelques exemples d'utilisation en synthèse :
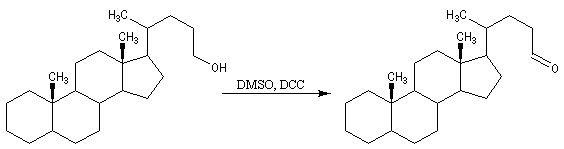
A l'heure actuelle l'oxydation de Swern est une réaction largement utilisée dans les synthèses organiques multiétapes de produits complexes. Un inconvénient est la formation de diméthylsulfure particulièrement malodorant. Des procédures utilisant le dodécylméthylsulfure (C12H25SCH3), permettent de réaliser des oxydations de Swern "sans odeur". Il existe plusieurs variantes de l'oxydation de Swern. Dans l'oxydation de Parikh-Doering, le DMSO est activé par un mélange de SO3 et de pyridine [35].
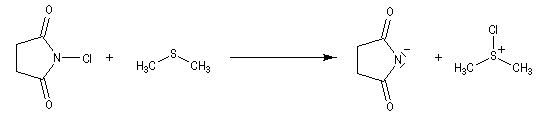
Oxydation de Corey-Kim
La première étape est la préparation du réactif par réaction, in situ, entre le diméthylsulfure et le N-chlorosuccinimide (NCS), un dérivé chloré du succinimide. [28].

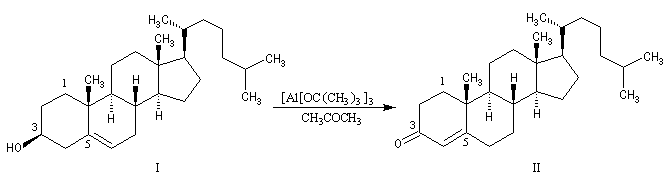
Oxydation d'Oppenauer
Il s'agit d'une méthode d'oxydation douce des alcools secondaires. On peut la regarder comme la réaction inverse de la réduction de Meerwein-Ponndorf et Verley. On utilise l'isopropylate d'aluminium ou le tertiobutylate d'aluminium comme catalyseurs.

Le réactif de Dess-Martin est un oxydant des alcools primaires et secondaires. Sa préparation s'effectue en deux étapes [25] :
- L'acide 2-iodobenzoïque peut être facilement préparé par une réaction de substitution nucléophile par les ions iodure sur le sel de diazonium
de l'acide 2-aminobenzoïque. L'oxydation de l'acide 2-iodobenzoïque par
le bromate de potassium fournit un composé intermédiaire appelé IBX. Ce
dernier peut être utilisé comme oxydant en solution dans le DMSO. Il
peut se décomposer brutalement sous l'action d'un choc
ou d'une élévation brusque de la température. Il faut donc le manipuler avec précautions.
Des procédures destinées à stabiliser l'IBX par des mélanges variés ont
été mises au point. Un exemple est le SIBX qui est un mélange d'IBX,
d'acide benzoique et d'acide orthophtalique [31].
Notons qu'il est possible de remplacer KBrO3 par le mélange KHSO5/KHSO4/K2SO4 (oxone), en solution aqueuse, ce qui permet d'éviter la manipulation du bromate de potassium et du dibrome toxiques tous les deux .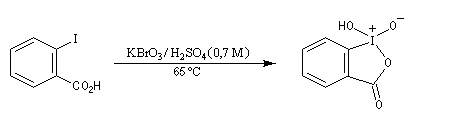
- par réaction entre l'IBX et l'anhydride acétique en présence d'APTS
comme catalyseur, on obtient le
1,1,1-triacétoxy-1,1-dihydro-1,2-benziodoxol-3(1H)-one, un composé
hypervalent de l'iode, encore appelé réactif de Dess Martin (symbolisé
par DMP pour Dess Martin Périodinane). Ce composé est plus soluble que
l'IBX dans la plupart des solvants usuels.
Le réactif de Dess-Martin est utilisé comme oxydant des alcools primaires (et dans certains cas secondaires).
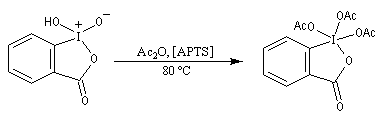

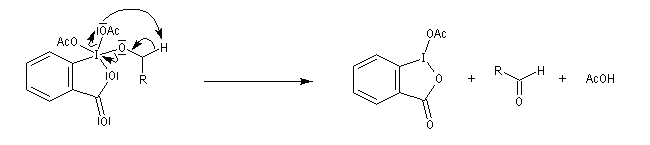
Propriétés acides
Les alcools ne manifestent aucune propriétés acido-basiques dans l'eau. Dans ce solvant, l'ionisation de la liaison OH d'un alcool comme le méthanol est extrêmement faible. Ainsi la constante thermodynamique de la réaction suivante vaut : K = 10-16 à 25 °C.
 |
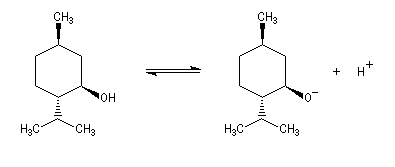
Les ions alcanolate sont des bases fortes nivelées par l'eau en ions hydroxyde OH-.
L'ajout de quelques gouttes d'éthanolate de sodium dans une solution
aqueuse de phénolphtaléine provoque l'apparition d'une coloration rose
qui témoigne de la présence d'ions HO-.
|
Alcool
|
CH3OH
|
C2H5OH
|
(CH3)2CHOH
|
(CH3)3COH
|
pKa (ROH/RO-)
|
16
|
18
|
18
|
19
|
A propos de l'acidité des alcools : la rationalisation de la différence d'acidité des alcools appartenant à différentes classes a déjà fait couler beaucoup d'encre. Longtemps attribuée à l'effet inductif donneur des groupes alkyles, la basicité plus grande de l'ion tertiobutylate par rapport à l'ion méthylate est due, pour une bonne part, à la solvatation moins importante de cette base dans les solvants protiques (schématiquement, plus un ion est volumineux, moins il est solvaté). Cela a été notamment montré par R. Mc Iver (Université de Californie Irvine) dans les années 70, en utilisant une technique spéciale de spectrométrie de masse (la résonance cyclotronique ionique) qui permet d'étudier les réactions chimiques en l'absence de solvatation.
Le couple menthol-ion mentholate a été souvent utilisé pour déterminer les pKa des couples acido-basiques comme alternative aux méthodes électrochimiques car les pouvoirs rotatoires spécifiques de l'alcool et de son sel sont très différents.
Plusieurs méthodes sont mises en œuvre pour déprotoner quantitativement les alcools.
- La première consiste à déplacer l'équilibre de dissociation de l'alcool en utilisant une base plus forte que l'alcoolate : NaH et NaNH2 sont des réactifs intéressants car les acides conjugués des bases sont gazeux et donc facilement éliminés du milieu réactionnel.
Couple
|
H2/H-
|
NH3/NH2-
|
pKa
|
35
|
38
|
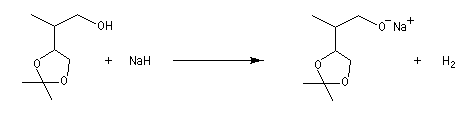
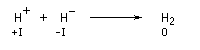
- Un moyen très simple et très efficace pour déprotoner les
alcools consiste à déplacer l'équilibre en utilisant comme réaction
couplante, la réduction de l'ion H+ par un métal alcalin.
Avec les alcools primaires, les plus faciles à déprotoner, on utilise le sodium :
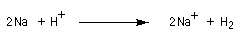
E0 (Na+/Na) = -2,7 V. Avec les alcools tertiaires comme le tertiobutanol qui sont moins réactifs on utilise le potassium.
- Les alcools sont déprotonés de façon quantitative par les composés organométalliques. Lorsqu'on effectue une synthèse avec ces composés sur un substrat possédant une fonction alcool, on engage cette fonction dans un groupe protecteur. Le dihydropyrane (DHP) est un éther d'énol couramment utilisé dans ce but.
L'atome d'oxygène des alcools manifeste des propriétés basiques. Les alcools peuvent être protonés en présence d'un acide fort comme l'acide sulfurique.
Alcool
|
CH3OH
|
CH3CH2OH
|
(CH3)2COH
|
pKa
|
-2,2
|
-2,4
|
-3,8
|
Propriétés nucléophiles de l'oxygène
Synthèse de Williamson des éthers
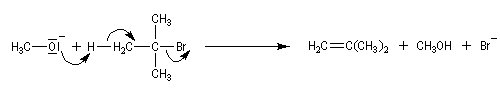
L'atome d'oxygène des alcools n'est pas suffisamment nucléophile pour déplacer directement des nucléofuges moyens. Un moyen d'exalter la réactivité nucléophile de l'oxygène est d'utiliser l'ion alcoolate.
La synthèse A. W. Williamson des éthers est basée sur la réaction de substitution nucléophile entre un alcoolate et un halogénure. La nucléophilie de l'alcoolate est exaltée par l'utilisation d'un solvant dipolaire aprotique comme le DMSO. Il s'agit d'une substitution nucléophile bimoléculaire. Ainsi, la méthode est particulièrement efficace lorsque le substrat est un halogénure primaire.
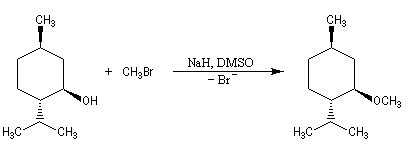
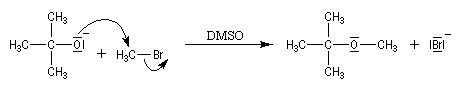
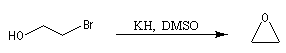

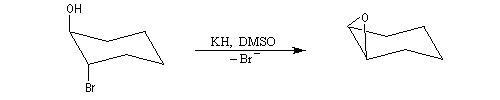
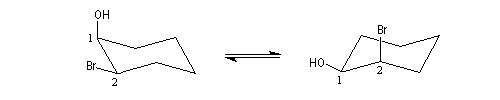
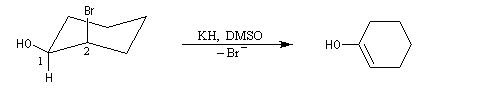
Par une méthode analogue, on sait synthétiser des éthers cycliques à 3, 4, 5, 6, 7 chaînons. Les meilleurs rendements sont obtenus pour les cycles à 3, 5 et 6 chaînons. Plusieurs facteurs interviennent pour déterminer ce pourcentage :
- Dans le cas des cycles à trois chaînons la contrainte de cycle est défavorable mais la probabilité de rencontre entre nucléophile et nucléofuge est très grande. Le facteur entropique est très favorable.
- L'entropie d'activation d'une réaction intramoléculaire est plus faible que celle d'une réaction intermoléculaire car la première implique une seule molécule tandis que la seconde en implique deux. Dans le premier cas, le nucléophile et le nucléofuge appartiennent à la même molécule alors que dans le second cas, ils appartiennent à des molécules différentes. On peut minimiser les réactions intermoléculaires en travaillant avec de grandes dilutions.
Alcoolyse des halogénures tertiaires
La synthèse des éthers dérivant de dérivés halogénés tertiaires est néanmoins possible par un mécanisme monomoléculaire SN1 s'il peut se former un carbocation relativement stable. Le nucléophile est alors moins puissant puisque c'est simplement l'alcool.
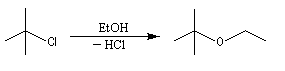
Hydroxyacétalisation
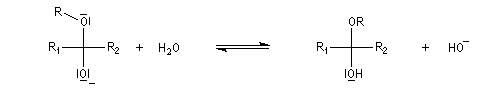
La réaction entre un alcool et un aldéhyde conduit à un hydroxyacétal. Avec une cétone on obtient un hydroxycétal. La transformation conduit à un équilibre pour lequel les produits sont défavorisés.
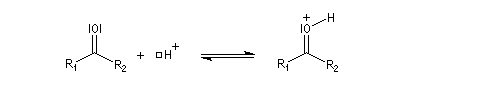
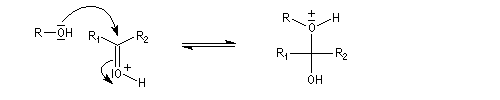
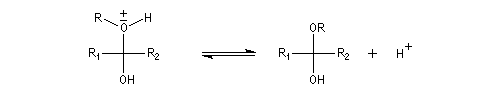
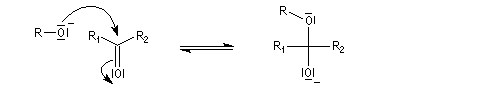
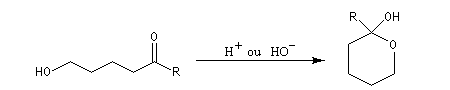
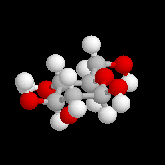
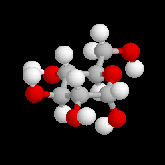
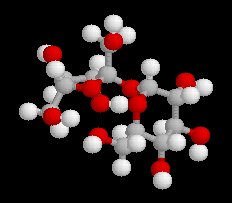
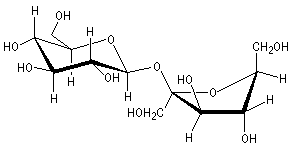
Le glucose naturel est le (2R, 3S, 4R, 5R)- 2, 3, 4, 5, 6-pentahydroxyhexanal. Il est représenté ci-dessous en projection de Fischer et en utilisant le mode de représentation de Cram.

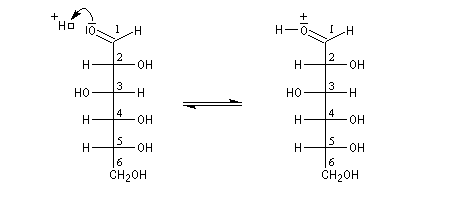
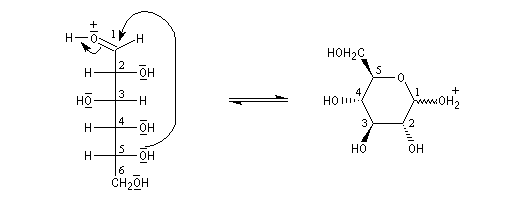
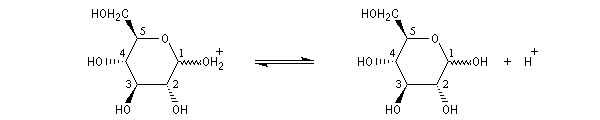
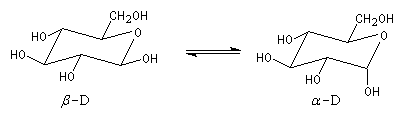
Le b-D-glucopyranose est représenté à gauche et le a-D-glucopyranose est représenté à droite. |
- Facteur stérique : la préférence des substituants à adopter une position équatoriale est un phénomène général bien connu chez les dérivés substitués du cyclohexane.
- Facteur électronique : l'effet anomère correspond à la préférence axiale d'un substituant X fortement électronégatif situé sur l'atome de carbone
en a de l'oxygène dans un hétérocycle du type pyrane.
La conformation II est favorisée par rapport à la conformation I.
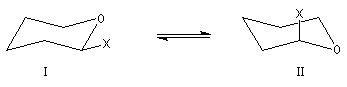
- Solvatation : elle joue un rôle très important en solution aqueuse. Celui-ci est malheureusement difficile à rationaliser de façon simple.
Composé
|
a-D-glucopyranose
|
b-D-glucopyranose
|
Mélange à l'équilibre
|
[a]D (°.g-1.cm3.dm-1)
|
112
|
19
|
52,2
|
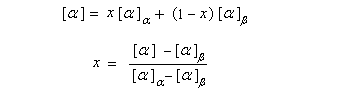
Composé
|
a-D-glucopyranose
|
b-D-glucopyranose
|
x (équilibre)
|
0,36
|
0,64
|
Synthèse des acétals et des cétals
Les hydroxyacétals et les hydroxycétals peuvent réagir avec un équivalent d'alcool pour donner respectivement des acétals et des cétals. La transformation conduit à un équilibre.
Comme on l'a vu précédemment, la formation des hydroxyacétals et des hydroxycétals est l'objet d'une catalyse acido-basique générale. En revanche, la synthèse des acétals est catalysée spécifiquement par les acides.
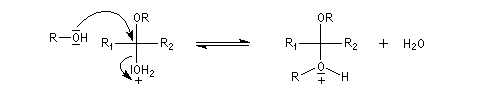
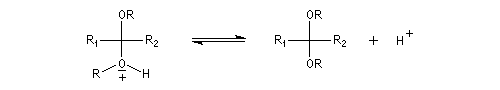
On utilise souvent un diol comme l'éthane-1,2-diol car avec ces composés, on obtient des acétals cycliques. La réaction est alors thermodynamiquement moins défavorable grâce à l'effet entropique (deux molécules conduisent à deux molécules).
La séquence réactionnelle suivante illustre l'utilisation d'un groupe protecteur pour le groupe carbonyle dans une synthèse magnésienne d'alcool :
- protection ;
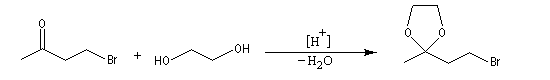
- formation du magnésien et addition avec le carbonylé ;
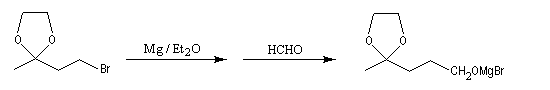
- déblocage du groupe carbonyle.
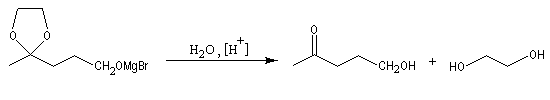
Les diols peuvent être protégés par formation d'un acétal avec l'acétone qui est peu coûteuse. Ce mode de protection est utilisé notamment dans la chimie des sucres.
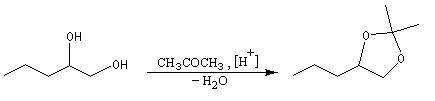
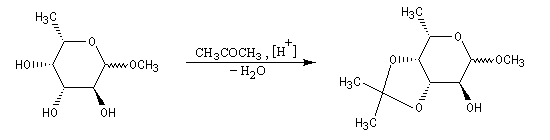
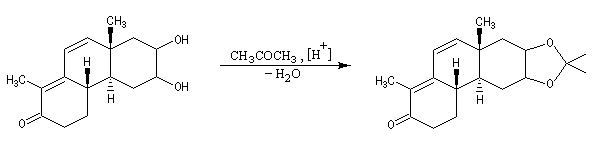
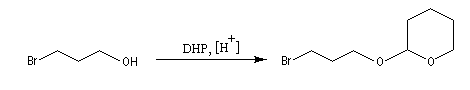
Acylation
Bilan
Une réaction d'acylation consiste formellement à substituer l’atome d’hydrogène du groupe -OH par un groupement acyle R-CO-. On peut y parvenir en effectuant la réaction entre l'alcool et l'acide carboxylique ou l'un de ses dérivés : halogénure d'acyle, anhydride ou ester.
Avec les deux premiers, la réaction est à la fois totale et rapide. Avec l'acide, elle conduit à un équilibre qu'on peut déplacer dans le sens de la formation de l'ester. Elle nécessite l'utilisation d'un catalyseur. La réaction entre un alcool et un ester est appelée transestérification. Les hydroxyacides conduisent aux lactones par estérification intramoléculaire.
Acylation par un chlorure d'acyle ou un anhydride
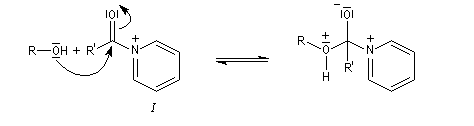
On effectue la réaction entre l'alcool et le chlorure d'acyle ou l'anhydride en présence d'une amine tertiaire comme la pyridine ou la diméthylaminopyridine DMAP (catalyseur de Steglich).
- l'addition nucléophile de l'alcool sur le chlorure d'acyle conduit à un intermédiaire tétraédrique ;
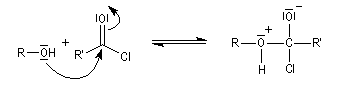
- la fragmentation de cet intermédiaire fournit l'ester protoné ;
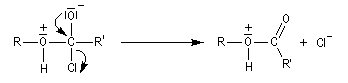
- en présence de pyridine qui joue le rôle de piège à protons, l'acide précédent fournit l'ester et le chlorure de pyridinium.
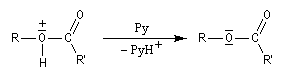
Plus précisément, la réaction entre le chlorure d'acyle et la pyridine fournit un ion acylaminium intermédiaire I.

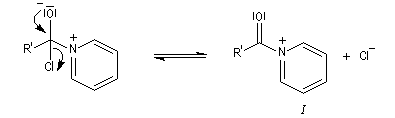

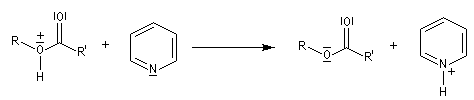
- sur le plan cinétique elle permet l'activation du chlorure d'acyle par formation de l'intermédiaire I ;
- sur un plan thermodynamique, c'est une base qui fixe les ions H+.
La réaction entre un acide carboxylique et un alcool est appelée estérification de Fischer. On obtient un ester et de l'eau.
La réaction entre l'acide butanoïque et le méthanol s'écrit :
- sur le plan thermodynamique, la réaction est limitée. Avec un alcool primaire le rendement est de 66 % si l'alcool et l'acide sont introduits en proportions stœchiométriques. Le rendement est nettement plus faible avec des alcools de classe supérieure.
- sur le plan cinétique, la réaction est très lente à la température ordinaire, en l'absence de catalyseur. Sa vitesse est accrue par élévation de la température et en présence d'un catalyseur. On utilise souvent H2SO4 ou l'acide paratoluènesulfonique (APTS). Notons que la concentration en acide ne doit pas être trop grande afin de ne pas protoner l'oxygène de l'alcool ce qui bloquerait son pouvoir nucléophile.
- éliminer l'ester au fur et à mesure de l'avancement de la réaction par distillation fractionnée si c'est le constituant le plus volatil (ce qui est souvent le cas car les esters ne sont pas associés par liaison hydrogène) ;
- éliminer l'eau en ajoutant du toluène (ou du benzène) au milieu réactionnel et en utilisant un décanteur de Dean-Stark. L'ester et le toluène doivent ensuite être séparés par distillation.
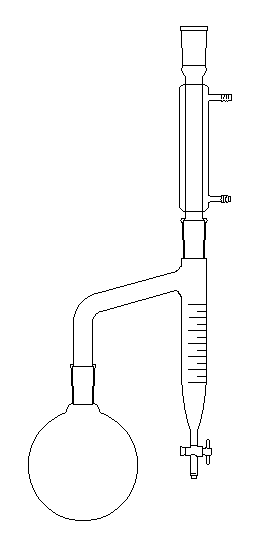 |
Le dessin de gauche et la photographie ci-dessous représentent un
montage permettant la préparation d'un ester en utilisant un décanteur
de type Dean-Stark. 
Dans le ballon, on réalise un mélange d'acide, d'alcool et de toluène (on utilise aussi le benzène mais l'usage de ce dernier répond à une réglementation précise du fait de sa toxicité). |
Un mode opératoire possible pour la préparation de l'éthanoate de butyle est donné ci-dessous :
On introduit dans le ballon 0,25 mol d'acide acétique (éthanoïque d = 1,05) et 0,25 mol de butan-1-ol (d = 0,81). On ajoute 30 mL de toluène et environ 0,15 g d'acide paratoluènesulfonique APTS ainsi que quelques grains de pierre ponce.
Le mélange est chauffé avec un chauffe-ballon tant que l'eau est entraînée.
Avec un appareil de Dean-Stark gradué on peut tracer la courbe donnant V en fonction du temps (remarque : si l'on trace V en fonction de 1/t , on obtient pratiquement une droite).
En série cyclique, la vitesse d'acétylation d'alcools tels que le tertiobutylcyclohexanol dépend de l'orientation axiale ou équatoriale du groupe hydroxyle.
Mécanisme de l'estérification des alcools primaires et secondaires AAC2
Le marquage isotopique (18O) de l'oxygène de l'alcool, suivi de l'analyse par spectrométrie de masse des produits, montre que cet atome se retrouve dans l'ester.
- addition de H+ sur le carboxyle de l'acide qui exalte le caractère électrophile du carbone du groupe carboxyle ;
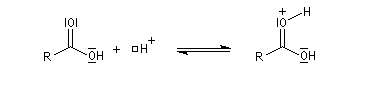
- addition de l'alcool sur le carboxyle activé formation
d'un intermédiaire tétraédrique, étape bimoléculaire cinétiquement
déterminante ;
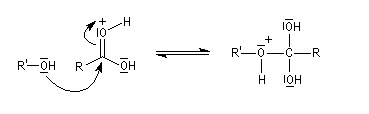
- prototropie au niveau de l'intermédiaire tétraédrique et amélioration du caractère nucléofuge de -OH ;
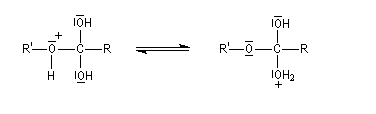
- fragmentation de l'intermédiaire tétraédrique avec départ du nucléofuge H2O ;
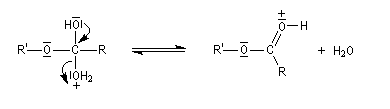
- déprotonation du carboxyle et régénération du catalyseur.
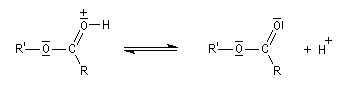
Mécanisme de l'estérification des alcools tertiaires AAL1 Les alcools tertiaires comme le 2-méthylpropan-2-ol peuvent également être estérifiés en utilisant comme agent acylant un anhydride d'acide ou un chlorure d'acyle et un catalyseur tel que ZnCl2. L'exemple suivant concerne la préparation de l'éthanoate de 2-méthylpropyle dont on trouvera un mode opératoire à la référence [24].
Le mécanisme est un cas particulier de mécanisme SN1 qui est noté AAL1 car la liaison qui se rompt dans l'étape cinétiquement déterminante est celle de l'alcool, cette étape étant monomoléculaire.
- réaction entre l'alcool et le catalyseur acide de Lewis ;
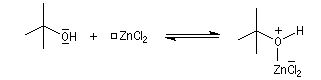
- l'étape cinétiquement déterminante correspond à la rupture de la liaison C-O de l'alcool avec formation d'un carbocation ;
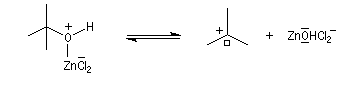
- addition de l'anhydride d'acide sur le carbocation ;
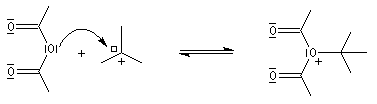
- fragmentation de l'adduit avec formation de l'ester et d'un ion acylium ;
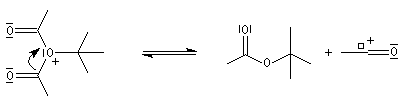
- formation de l'acide parent et régénération du catalyseur.
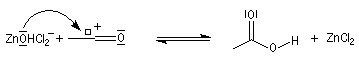
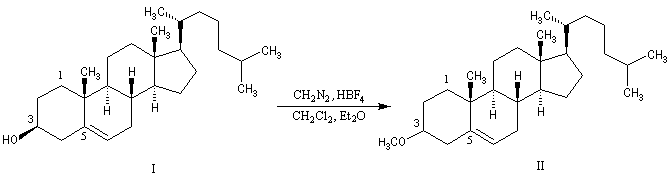
Méthylation par le diazométhane
Les alcools peuvent être méthylés par le diazométhane en présence d'un acide de Lewis comme BF3. Exemple [27]. Cette réaction nécessite des précautions particulières car le diazométhane est un agent méthylant très toxique.
Estérification par l'acide nitrique
La nitroglycérine est le représentant le plus connu des nitrates d'alkyles. Ces composés sont tous très instables et donc extrêmement dangereux à manipuler.
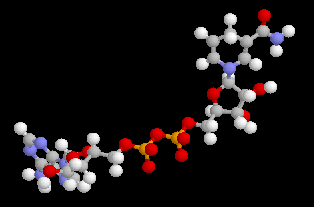
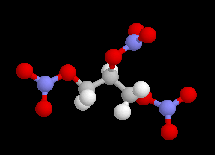
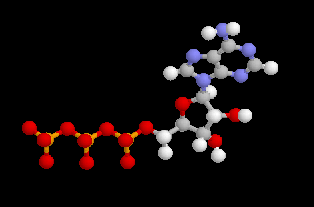
L'adénosine triphosphate (ATP) est un coenzyme nucléotidique. Dans les conditions de pH rencontrées en milieu biologique, l'ATP est essentiellement sous forme ATP4- : pKa (HATP3-/ATP4-) = 6,5.
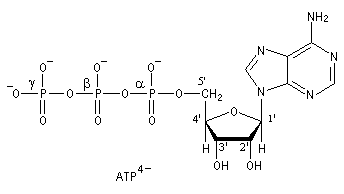
| On peut distinguer trois parties dans l'ATP : l'association de l'adénine et du ribose constitue le nucléoside adénosine. Il y a ensuite une succession de trois groupes phosphate associés au groupe 5'-OH
de l'adénosine par une liaison phosphoester. Les groupes phosphate sont
liés entre-eux par des liaisons phosphoanhydrides. L'ATP constitue la
réserve principale d'énergie chimique de la cellule vivante. L'hydrolyse
des liaisons phosphoanhydrides est fortement exergonique : Pour l'hydrolyse de l'ATP en ADP : DrG0' = -34,5 kJ.mol-1 Notons que dans la cellule, le coenzyme est complexé avec des ions Mg2+ lié aux phosphates a et b . |
Protonation en milieu acide
Généralités
Le groupe hydroxyle d'un alcool est un mauvais nucléofuge ce qui est à mettre en relation avec son caractère de base forte. La protonation du groupe hydroxyle accroît considérablement les possibilités de rupture de la liaison carbone-oxygène car le nucléofuge est maintenant une petite molécule stable : l'eau.
Formation de carbocations
La rupture de la liaison carbone-oxygène peut conduire à un carbocation. C'est le cas avec les alcools tertiaires. Certains peuvent être suffisamment stables pour pouvoir être observés. Il est ainsi très facile d'obtenir le carbocation triphénylméthyle à partir du triphénylméthanol par ajout d'acide sulfurique.
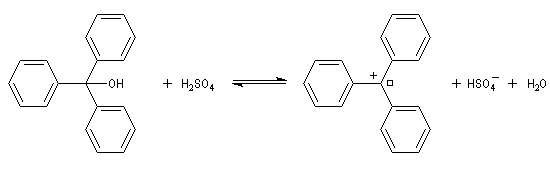
 |
A la température ordinaire, le triphénylméthanol est un
solide de couleur blanche (TF = 136 °C). Dans le bécher j'ai mis une
petite quantité de triphénylméthanol solide. L'ajout de quelques gouttes
d'acide sulfurique concentré provoque l'apparition d'une couleur rouge
intense. Cette expérience, réalisée en 1901 indépendamment par Norris et
Kehrmann, fut la première mise en évidence de l'intervention de carbocations en chimie organique. L'acide sulfurique protone l'alcool et permet le départ du nucléofuge H2O. L'équilibre est déplacé vers la droite en raison de la stabilité du cation triphénylméthyle (carbocation trityle) et du caractère déshydratant de l'acide sulfurique concentré qui capte l'eau formée. |
Structure du cation trityle : la structure du carbocation triphényleméthyle (carbocation trityle) dans un composé solide, a été déterminée par diffraction des rayons X dans les années 60 (A.H. Gomes et C.H. Mac Gillavry). Les liaisons partant de l'atome de carbone central sont dans un même plan. Du fait de la répulsion des atomes d'hydrogène situés en ortho, les cycles adoptent une conformation non plane et font des angles de 54° par rapport au plan de ces liaisons. Globalement, le cation a la forme d'une hélice qui rappelle celle du radical triphénylméthyle. L'existence d'une lacune électronique portée par l'atome de carbone central permet une délocalisation des électrons sur un système de grande dimension. Cette délocalisation importante est à l'origine de la stabilité relativement grande du carbocation.
Le cation triphénylméthyle forme un système conjugué de grandes dimensions. Ce système absorbe la lumière dans le domaine visible d'ou la couleur observée qui est approximativement complémentaire de celle qui est absorbée.
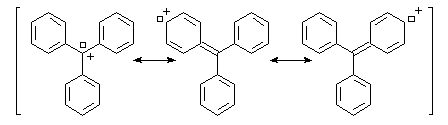
Mis à part le cas particulier étudié, les carbocations sont des espèces très réactives, qui n'apparaissent généralement que comme intermédiaire dans des réactions de substitution ou d'élimination.
Halogénation
Halogénation par les hydracides halogénés
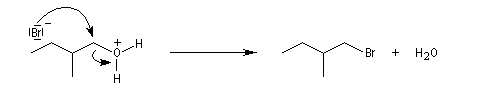
Alcools primaires
Avec HBr et HI, on peut synthétiser des dérivés halogénés à partir des alcools primaires. H+ protone l'alcool et I- ou Br- sont suffisamment nucléophiles pour déplacer l'eau par substitution nucléophile bimoléculaire. On peut aussi utiliser KI et KBr en milieu H2SO4 concentré. Cela revient moins cher que d'utiliser des acides halohydriques.
Alcools tertiaires
Un alcool tertiaire comme le 2-méthylpropan-2-ol (tertiobutanol) est transformé en chlorure par simple agitation avec l'acide chlorhydrique concentré à froid. Le mécanisme est une substitution nucléophile monomoléculaire SN1 avec formation d'un carbocation intermédiaire.
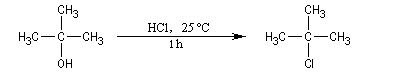
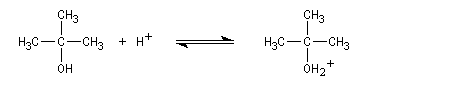
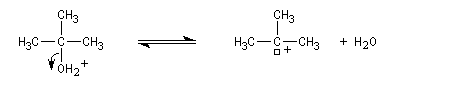
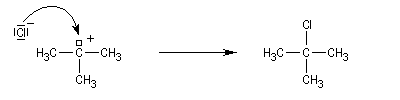
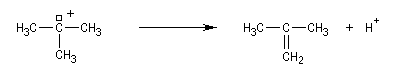
Les alcools secondaires ont une réactivité intermédiaire entre celle des alcools primaires et celle des alcools tertiaires. Ils sont assez plus rapidement transformés en halogénure à chaud par HI, HBr ou le mélange HCl, ZnCl2 que les primaires.
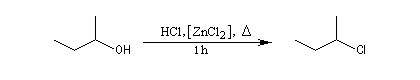
Test de Lucas des alcools
Le rôle catalytique de ZnCl2 dans l'halogénation par les ions chlorure est à la base d'un test des classes d'alcools mis au point par le chimiste américain H. J. Lucas. Le réactif de Lucas est une solution de ZnCl2 dans l'acide chlorhydrique concentré. On effectue un mélange de l'alcool à tester et du réactif. Le test repose sur la différence de réactivité des alcools des différentes classes vis à vis de la coupure C-O. Un test positif se traduit par l'apparition de deux phases car l'halogénure formé est peu miscible avec le mélange des réactifs.
Classe de l'alcool
|
Primaire
|
Secondaire
|
Tertiaire
|
Vitesse
|
très lent à chaud
|
rapide à chaud
|
rapide à froid
|
Halogénation par des réactifs inorganiques
Réactifs halogénants
Les alcools peuvent être convertis en dérivés halogénés grâce à une assez grande variété de réactifs halogénants :
Un réactif couramment employé est le chlorure de thionyle SOCl2.
 |
Le chlorure de thionyle peut être préparé par réaction entre SO2 et PCl5. On obtient SOCl2et POCl3
qui sont ensuite séparés par distillation fractionnée. L'arrangement
des doublets autour du soufre est tétraédrique (structure AX3E au sens de la théorie VSEPR). La molécule a la forme d'une pyramide irrégulière. Ce composé est hydrolysé de façon violente par l'eau en donnant HCl et SO2. C'est un réactif qu'il faut manipuler avec précautions. |
| Le trichlorure de phosphore PCl3 peut être préparé par union directe entre le phosphore (rouge) et le dichlore. C'est un composé très hygroscopique. Son hydrolyse par l'air humide produit HCl. Elle s'accompagne d'un brouillard (dû à l'existence d'un azéotrope eau-HCl). On dit par abus de langage qu'il fume à l'air. La molécule est pyramidale (voir la méthode VSEPR). |
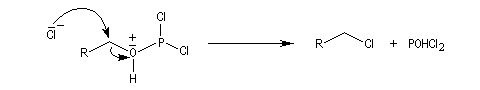
| Le pentachlorure de phosphore peut être obtenu par réaction entre PCl3 et Cl2. A l'état vapeur, il est constitué de molécules de formule PCl5. La molécule à la forme d'une bipyramide trigonale (voir la méthode VSEPR). A l'état solide, le pentachlorure de phosphore est constitué de cations PCl4+ et d'anions PCl6-. On continue à écrire PCl5 pour simplifier. Il est particulièrement hygroscopique et violemment hydrolysé par l'eau. |
Sur un substrat chiral, on observe l'inversion de configuration du centre chiral. L'exemple suivant, utilisant la projection de Fischer, concerne une réaction extraite du travail classique de Walden sur la chloration des acides maliques.
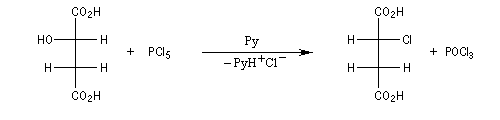
Lorsqu'elle est effectuée en présence de pyridine, la réaction entre le (2S)-octan-2-ol et SOCl2 fournit le (2R)-2-chlorooctane. La réaction est une substitution nucléophile bimoléculaire SN2. On observe l'inversion de Walden qui s'accompagne ici d'une modification de la configuration absolue du centre stéréogène.
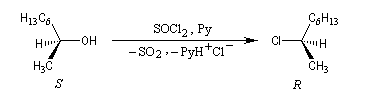

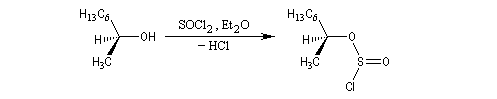
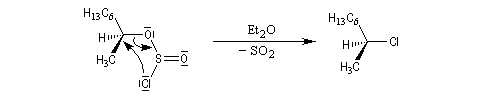
Sulfonylation
Bilan et conditions expérimentales
Une solution pour améliorer le caractère nucléofuge du groupe hydroxyle est de le remplacer par un autre groupe ! Le chlorure de paratoluènesulfonyle (TsCl) est un dérivé de l'acide paratoluènesulfonique (APTS).
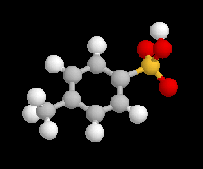 |
L'acide paratoluènesulfonique (APTS) peut être obtenu par
réaction de sulfonation entre le toluène et l'acide sulfurique. A la
température ordinaire, il se présente sous la forme d'un solide. Il
s'agit d'un acide fort : pK (TsOH/TsO-) = -7. L'APTS
est souvent utilisé comme catalyseur acide car il est soluble en milieu
organique. La base conjuguée correspondante n'est pas nucléophile ce qui limite les réactions secondaires. De plus, contrairement à l'acide sulfurique il n'est pas du tout oxydant.
La base conjuguée de l'APTS, l'ion paratoluènesulfonate ou tosylate est un excellent nucléofuge (base très faible). |
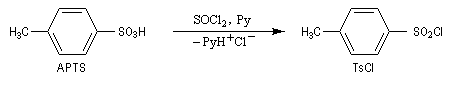
Les ions tosylate sont de très bons nucléofuges ce qui peut être mis en relation avec leur caractère de bases très faibles donc très stables. Ils peuvent être déplacés par de nombreux nucléophiles.

En milieu biologique les composés contenant des groupes hydroxyles peuvent être activés par transformation en groupes phosphates. Par exemple par formation d'uridinediphosphoglucose (UDPG).
Elimination : passage aux composés éthyléniques
Bilan, conditions expérimentales
Un moyen très simple pour préparer le cyclohexène consiste à chauffer le cyclohexanol avec de l'acide sulfurique ou de l'acide phosphorique concentrés. La réaction s'écrit :
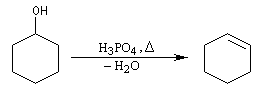
L'élimination peut être effectuée en présence d'un acide fort comme H2SO4 ou mieux H3PO4 qui ne présente pas l'inconvénient par rapport au précédent d'oxyder le substrat [2]. En milieu acide, l'alcool est protoné ce qui permet le départ d'eau bien meilleur nucléofuge que OH. On peut également utiliser des acide de Lewis tels que ZnCl2, BF3, I2 comme catalyseur de déshydratation. Un mode opératoire pour la préparation du cyclohexène se trouve dans [6].
Influence de la classe d'alcool
Des conditions typiques d'élimination à partir d'alcools de différentes classes sont les suivantes :
Classe d’alcool
|
Réactif
|
Température (°C)
|
Primaire
|
H2SO4 (98 %)
|
180
|
Secondaire
|
H2SO4 (50 %)
|
140
|
Tertiaire
|
H2SO4 (20 %)
|
80
|
Compétition entre élimination et substitution
Lorsqu'on chauffe de l'éthanol en présence d'acide sulfurique à 140 °C, on obtient essentiellement de l'éthoxyéthane. A 180 °C le produit majoritaire est l'éthène.
T (°C)
|
Réactif
|
Produit
|
Type de réaction
|
140
|
H2SO4 (98 %)
|
Ethoxyéthane
|
Intermoléculaire
|
180
|
H2SO4 (98 %)
|
Ethène
|
Intramoléculaire
|
Mécanismes
La déshydratation d'un alcool peut être regardée comme la réaction inverse de l'hydratation d'un alcène acido-catalysée. Avec les alcools tertiaires et secondaires, il y a formation d'un carbocation. Il s'agit d'un mécanisme de type E1. La protonation de la fonction alcool permet de transformer le mauvais groupe libéralble OH en un meilleur nucléofuge : l'eau.
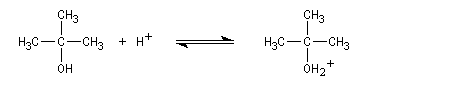
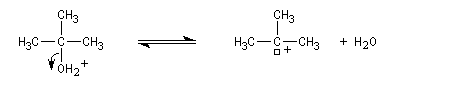
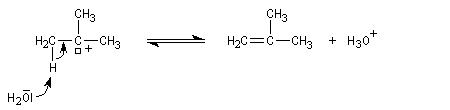
On s'intéresse à la déshydratation catalysée par un acide, du 2-méthylbutan-2-ol.
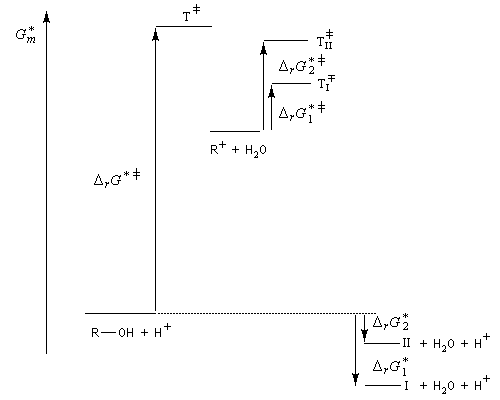
Stéréosélectivité
La déshydratation du butan-2-ol dans H2SO4 à 60 % à 25 °C fournit plusieurs composés avec les pourcentages suivants.
But-1-ène
|
(Z)-But-2-ène
|
(E)-But-2-ène
|
3 %
|
23 %
|
74 %
|

En revanche le (2R)-butan-2-ol et le (2S)-butan-2-ol qui sont énantiomères, fournissent le même alcène. La réaction n'est pas stéréospécifique.
Le passage par des carbocations explique l'existence de transpositions fréquentes dans ce type de réaction.
Recherche de structure Dans certains cas, les réactions d'élimination peuvent être mises à profit pour préciser la structure des alcools. Dans l'exemple ci-dessous, la position de la double liaison éthylénique dans les produits de déshydratation des alcools A et B peut être déterminée grâce à la réaction d'ozonolyse. Il est alors facile de préciser la structure de l'alcool de départ.
Transpositions
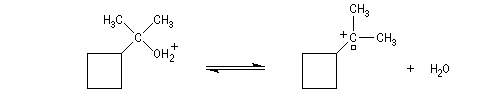
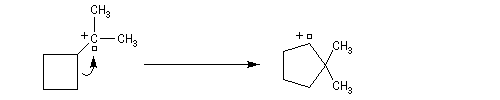
Transposition de carbocations On peut aussi assister à une réaction de transposition du carbocation. Dans l'exemple ci-dessous, celle-ci s'accompagne d'un agrandissement de cycle.
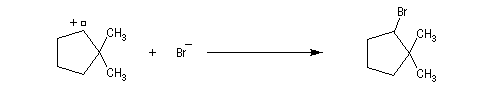
Transposition pinacolique Lorsqu'on traite en milieu acide le 2,3-diméthylbutane-2,3-diol, appelé communément pinacol, on observe une réaction de transposition conduisant à la 3,3-diméthylbutan-2-one. Cette réaction, qui constitue un des premiers exemples de transposition mis en évidence en chimie organique, s'appelle transposition pinacolique [20]. Notons que le pinacol peut être facilement obtenu par réduction duplicative de la propanone. Le mécanisme de la transposition est le suivant :
- protonation d'un hydroxyle du glycol ;
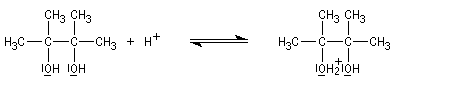
- formation d'un carbocation avec le départ d'une molécule d'eau ;

- migration d'un groupe hydrocarboné au sein du carbocation.
Notons qu'au cours de cette étape, il y a passage d'un cation tertiaire à un cation secondaire plus stable car il est substitué par un atome d'oxygène donneur par effet mésomère.
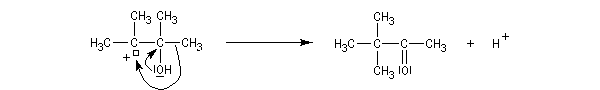
- le carbocation le plus stable se forme le plus rapidement ;
- l'aptitude migratoire des groupes est : Ph > H > R (alkyle).
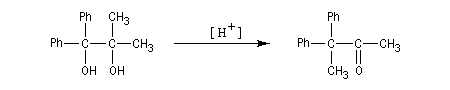
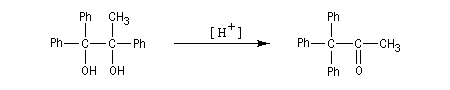
La transposition pinacolique peut également avoir lieu de façon intramoléculaire. La réaction suivante est l'une des étapes de la synthèse du longifolène par E. J.Corey.
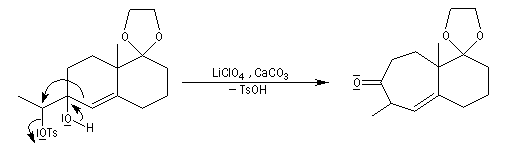
[1] Manuel d'expériences de chimie - UNESCO Société chimique de France - Université de Montpellier.
[2] P. Rendle, M. V. Vokins, P. Davis, Experimental Chemistry (Edward Arnold).
[3] L. F. Fieser, K. L. Williamson - Organic Experiments (D. C. Heath and Company).
[4] R. Adams, J. R. Johnson, C. F. Wilcox - Laboratory Experiments in Organic Chemistry (The Macmillan Company, Collier-Macmillan Limited).
[5] G. K. Helmkamp, H. W. Johnson Jr, Selected Experiments in Organic Chemistry (W. H. Freeman and Co).
[6] Vogel's Textbook of Practical Organic Chemistry (Longman).
[7] J. R. Mohrig, D.C Neckers, Laboratory Experiments in Organic Chemistry (D. Van Nostrand Company).
[8] R. Q. Brewster, C.A. Van der Werf, W. E. Mc Ewen, Unitized Experiments in Organic Chemistry (D. Van Nostrand Company).
[9] F. G. Mann, B.C. Saunders, Practical Organic Chemistry (Longman).
[10] M. T. Yip, D. R. Dalton, Organic Chemistry in the Laboratory (D. Van Nostrand Company).
[11] R. Danion-Bougot - BUP 764, p. 887, 1994.
[12] A. Fougerousse - BUP 817, p. 1473, 1999.
[24] A. M. Bernard et J. C. Maire - Maniuplations de chimie organique et de chimie minérale (Dunod 1969).
Articles
[13] D. R. Paulson, Journal of Chemical Education, 50, 1973.
[14] Dess, D. B. ; Martin, J. C. J. Org. Chem. 1983, 48, 4155-4156.
[15] Dess, D. B. ; Martin, J. C. J. Am. Chem. Soc. 1991, 1, 7277-7287.
[16] Corey, E. J. ; Mitra, R. B. ; Vatakencherry, P. A. ; J. Am. Chem. Soc. 86, 478 (1964).
[28] Corey E. J., C. U. Kim C. U., J. Am. Chem. Soc. 94, 7586 (1972).
[29] Mancuso, A. J. Swern, D. Synthesis, 1981, 165-185.
[35] Parikh, J. R., Doering, W. Von E, J. Am. Chem. Soc. 1967, 5505-5507.
[36] R. B. Woodward, F. Sondheimer, D. Taub, K. Heusler and W. M. McLamore J. Amer. Chem. Soc. 74, 4223 (1952.)
[37] R. Criegee, Ber. 64, 260 (1931.)
Liens
[17] Dess-Martin reagent
[18] Swern Oxidation
[19] Oxydation d'Oppenauer du cholestérol
[20] Pinacolone
[21] Moffatt Oxidation ; 4-tbutylcyclohexanone
[23] Aldehydes from primary alcohols : heptanal by J. C. Collins and W. W. Hesse
[25] Dess-Martin periodinane by R. K. Boeckman, P. Shao and J. J. Mullins
[26] Syntheses of (Diacetoxyiodo)arenes or Iodylarenes from Iodoarenes, with Sodium Periodate as the Oxidant by Pawel Kazmierczak, Lech Skulski, and Lukasz Kraszkiewicz
[27] Cholestanyl methyl ether by M. Neeman and William S. Johnson.
[30] Oxidation of alcohols by methylsulfide, N-chlorosuccinimide, triéthylamine by E. J. Corey, C. U. Kim and P. F. Misco.
[31] o-iodoxybenzoic acid IBX ; SIBX
[32] Cours de G. Myers, University of Harvard Chapitre très complet sur les réactions d'oxydation des alcools et d'autres fonctions. Nombreuses références bibliographiques.
[33] Oxydations en chimie organique
Ouvrages théoriques
A. Streitwieser Jr, C.H. Heathcock - Introduction to Organic Chemistry (Macmillan Publishing Co).
J. March - Advanced organic chemistry (Wiley Interscience).
F. A. Carey, R. S. Sunberg - Advanced Organic Chemistry, (Plenum Press 1990).
N. T. Ahn - Introduction à la chimie moléculaire, (Ellipses 1994).
P. Caubère - Les dérivés du soufre en chimie organique, (Masson).
J. C. Chottard, J. C. Depezay, J. P Leroux - Chimie fondamentale (Hermann 1982).
P. Laszlo - Logique de la synthèse organique. Cours de l'Ecole Polytechnique (Ellipses - 1993).
P. Atkins - General Chemistry (Scientific American Books W.H Freeman and Co).
J. Koolman, K.H Röhm - Atlas de biochimie (Médecine & Sciences ; Flammarion).
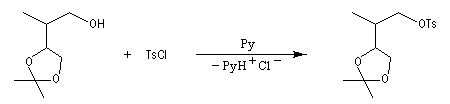
Aucun commentaire:
Enregistrer un commentaire